
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
Na2S2O3·5H2O可作为高效脱氯剂,工业上用硫铁矿(FeS2)为原料制备该物质的流程如下。

已知:I.气体A可以使品红溶液褪色,与硫化氢(H2S)混合能获得单质硫。
II.pH约为11的条件下,单质硫与亚硫酸盐可以共热生成硫代硫酸盐。
回答下列问题:
(1)沸腾炉中将粉碎的硫铁矿用空气吹动使之达到“沸腾”状态,其目的是 。
(2)吸收塔中的原料B可以选用 (填字母序号)。
A.NaCl溶液 B.Na2CO3溶液 C.Na2SO4溶液
(3)某小组同学用下图装置模拟制备Na2S2O3 的过程(加热装置已略去)。
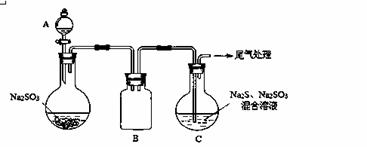
① A中使用70%的硫酸比用98%的浓硫酸反应速率快,其原因是 。装置B的作用是 。
② C中制备Na2S2O3发生的连续反应有:Na2S + H2O + SO2 ===Na2SO3 +H2S、
和Na2SO3 + S  Na2S2O3 。
Na2S2O3 。
(4)工程师设计了从硫铁矿获得单质硫的工艺,将粉碎的硫铁矿用过量的稀盐酸浸取,得到单质硫和硫化氢气体,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
对下列化学用语描述和理解都正确的是
原子结构示意图 ,可以表示
,可以表示 ,也表示
,也表示
B. 比例模型 可以表示水分子,也可以表示二氧化碳分子
可以表示水分子,也可以表示二氧化碳分子
C. 结构示意图为 的阴离子都不能破坏水的电离平衡
的阴离子都不能破坏水的电离平衡
D.电子式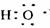 可以表示羟基,也可以表示氢氧根离子
可以表示羟基,也可以表示氢氧根离子
查看答案和解析>>
科目:高中化学 来源: 题型:
金属及其化合物在国民经济发展中起着重要作用。
(1)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:

该反应的氧化剂是_________,当生成19.2gCu时,反应中转移的电子为_____mol。铜在潮湿的空气中能发生吸氧腐蚀而生成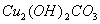 (碱式碳酸同)。该过程负极的电极反应式_______________。
(碱式碳酸同)。该过程负极的电极反应式_______________。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(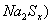 分别作为两个电极的反应物,固体
分别作为两个电极的反应物,固体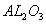 陶瓷(可传导
陶瓷(可传导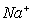 )为电解质,其原理如图所示:
)为电解质,其原理如图所示: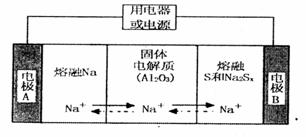
①根据下表数据,请你判断该电池工作的适宜温度应控制在_______。

②放电时,电极A为____极,S发生_______反应。
③放电时,内电路中的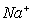 的移动方向为_______(填“从A到B”或“从B到A”)。
的移动方向为_______(填“从A到B”或“从B到A”)。
④充电时,总反应为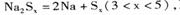 Na所在电极与直流电源_______极相连,阳极的电极反应式为________.
Na所在电极与直流电源_______极相连,阳极的电极反应式为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2H2(g)+O2(g)====2H2O(l)
ΔH=-571.6 kJ·mol-1 ①
2CH3OH(l)+3O2(g)====2CO2(g)+4H2O(l)
ΔH=-1 452 kJ·mol-1 ②
H+(aq)+OH-(aq)====H2O(l) ΔH=-57.3 kJ·mol-1 ③
下列说法正确的是( )
A.H2(g)的燃烧热ΔH=-571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.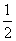 H2SO4(aq)+
H2SO4(aq)+ 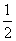 Ba(OH)2(aq)====
Ba(OH)2(aq)====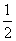 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)====CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
钠及其化合物具有广泛的用途。
(1)工业上制备金属钠的常用方法是______________。试写出制备金属钠的化学方程式 。金属钠可用于 (写出Na在熔点低方面的一种用途)。
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池。该电池的结构如图所示:

①正极的电极反应式为________________,电池工作时物质A可循环使用,A物质的化学式为________________。
②请写出检验Na2CO3中钠元素的方法 。
(3)常温下,浓度均为0.1 mol·L-1的下列五种钠盐溶液的pH如下表:
| 溶质 | CH3COONa | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 11.6 | 10.3 | 11.1 |
上述盐溶液的阴离子中,结合H+能力最强的是 ,根据表中数据,浓度均为0.01 mol·L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是_______(填序号)。
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯。
①常温下,当300 mL 1 mol·L-1的NaOH溶液吸收4.48 L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为________________________。
②已知几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加某浓度的NaOH溶液时,________(填离子符号)先沉淀,Ksp[Fe(OH)2]______Ksp[Mg(OH)2](填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在25°C、100 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+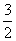 O2(g)===CO2(g)+2H2O(l) ΔH=725.8 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=725.8 kJ·mol-1
B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-725.8 kJ·mol-1
D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=1 452 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com