
����Ŀ��ijУ��ѧ�С��Խ̲��С��ⶨ������������������ʵ�飨��ͼ1�������˴Ľ��������ͼ2��ѡ���ݻ�Ϊ40mL���Թ���Ϊ��Ӧ���������Ժܺõ�ע������װ��ʵ�鷽�����С�����Աȷ���ͼ1��ͼ2ʵ�飬�ش������й����⣺

I.����ͼ1�ش��������⣺
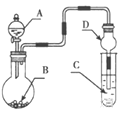
��1��ָ��ʵ����A��B���������ƣ�A___��B___��
��2��д������ȼ�շ�Ӧ�ı���ʽ___��
��3��ʵ���е�ȼ����۲쵽___��������Ϩ����ȴ�����º��ɼУ��۲쵽___��
��4���ɴ�ʵ�����֪ʣ����Ҫ����Ļ�ѧ������___(��һ������)��
II.����ͼ2ʵ�鷽�����У�ʵ��IJ����������£��ٽ�����װ���Թ��У���30mL��ע������������10mL�̶ȴ�������ͼ2����ʾ�����ӷ�ʽ�̶��ã��ٽ����ɼмн���Ƥ�ܢڵ�ȼ�ƾ��Ƣ۳�ȥ�ƾ��ƣ����Թ���ȴ���ɿ����ɼТܶ�ȡע�������������ݡ�
��5����ͼ1�Ƚϣ�ͼ2װ�õ��ŵ���___(��һ�㼴��)��
��6������ͼ2װ�ò�õ������������С��![]() ������ܵ�ԭ����___(дһ������)��
������ܵ�ԭ����___(дһ������)��
��7��ͼ2ʵ����ע������������10mL�̶ȴ�����ǰ�Ƶ�ԼΪ___mL�̶ȴ���ֹͣ(���Ե����������)��
��8����ͼ2װ���и����ݻ�Ϊ80mL�Թ��Ҳ�ʹ�üе��ɼУ��������������䣬Ϊȷ��ʵ��ɹ��������ǰע��������ǰ������Ӧ������___mL�̶ȴ�(������)��
���𰸡�ȼ�ճ� �ձ� ����+����![]() ���������� ����ȼ�գ������������̣��ų������� ˮ�ص��ܽ��뼯��ƿ������ˮ�����Լ���ڼ���ƿʣ���������
���������� ����ȼ�գ������������̣��ų������� ˮ�ص��ܽ��뼯��ƿ������ˮ�����Լ���ڼ���ƿʣ���������![]() ��ȼ�ջ�֧��ȼ�� ������ʹʵ����۸���ȷ �����������װ��©�� 2 20
��ȼ�ջ�֧��ȼ�� ������ʹʵ����۸���ȷ �����������װ��©�� 2 20
��������
��1������װ��ͼ�ش�A��B���������ƣ�
��2������ȼ���������������ף�
��3������ȼ�ղ����������̣��ų������ȣ���ȼ������������������٣�
��4����Ӧ��ɺ��ס����嶼��ʣ�ࣻ
��5��װ��2��ȷ������������仯��
��6��������Ӧ����ȫ��װ��©������õ������������С��![]() ��
��
��7�������п��������Ϊ40mL���������������Ϊ![]() ��
��
��8�������������������Ϊ![]() ���㣻
���㣻
��1������װ��ͼ�� ����A��ȼ�ճס�����B���ձ���
��2������ȼ���������������ף���ȼ�շ�Ӧ�ı���ʽ�ǣ�����+����![]() ���������ף�
���������ף�
��3������ȼ���ܹ۲쵽�����������̣��ų������ȣ�����ռ���������![]() ����ȼ����������������������٣����Դ�����Ϩ����ȴ�����º��ɼУ��۲쵽ˮ�ص��ܽ��뼯��ƿ������ˮ�����Լ���ڼ���ƿʣ���������
����ȼ����������������������٣����Դ�����Ϩ����ȴ�����º��ɼУ��۲쵽ˮ�ص��ܽ��뼯��ƿ������ˮ�����Լ���ڼ���ƿʣ���������![]() ��
��
��4����Ӧ��ɺ��ס����嶼��ʣ�࣬˵��ʣ�����岻ȼ�ջ�֧��ȼ�գ�
��5��װ��2��ȷ������������仯��ʹʵ����۸���ȷ��
��6������������������Ӧ����ȫ��װ��©������õ������������С��![]() ��
��
��7�������п��������Ϊ40mL���������������Ϊ![]() �����������Ϊ8mL������ע������������10mL�̶ȴ�����ǰ�Ƶ�ԼΪ2mL�̶ȴ���ֹͣ��
�����������Ϊ8mL������ע������������10mL�̶ȴ�����ǰ�Ƶ�ԼΪ2mL�̶ȴ���ֹͣ��
��8�������ǰע��������ǰ������Ӧ������xmL�̶ȴ���![]() ��x=20��
��x=20��


 ���ɶ��ȫ���ƿؾ�ϵ�д�
���ɶ��ȫ���ƿؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼװ�ý���ʵ�飬��Һ��A��μ��뵽����B�У�����������ȷ����
A.��AΪH2O2��BΪMnO2��C��ʢ��Na2S��Һ�� C����Һ�����
B.��AΪŨ���ᣬBΪMnO2��C��ʢ��KI������Һ��C����Һ����ɫ
C.��AΪŨ��ˮ��BΪ��ʯ�ң�C��ʢ��AlCl 3��Һ�� C���Ȳ�����ɫ������������ܽ�
D.��AΪŨH2SO4 ��BΪCaCO3��C��ʢ��Na2SiO3 ��Һ��C����Һ���ְ�ɫ������֤���ǽ�����S��C��Si
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ӷ�Ǧ����Ǧ�ࣨ��PbSO4��PbO2��Pb�ȣ��л���Ǧ��һ�ֹ����������£�

��֪��Ũ�����PbO2��Ӧ��Ksp��PbCl2����2.0��10��5��Ksp��PbSO4����1.5��10��8��PbCl2��s����2Cl����aq��=PbCl42����aq��������˵���������
A. ����������Ǧ������������Դ�����úͷ�ֹ�ؽ�����Ⱦ
B. ������п���Ũ�������Ũ����
C. ����١��ڡ����о��漰���˲���
D. PbSO4��s����2Cl����aq��![]() PbCl2��s����SO42����aq����ƽ�ⳣ��Ϊ7.5��10��4
PbCl2��s����SO42����aq����ƽ�ⳣ��Ϊ7.5��10��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����仯�����ڹ�ҵ����������;�����������Ҫ�ɷ�ΪMg2B2O5��H2O��Fe3O4����������Fe2O3��FeO��CaO��Al2O3��SiO2��)Ϊԭ���Ʊ�����(H3BO3)�Ĺ���������ͼ��ʾ��
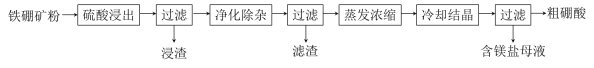
��֪������Ϊ��ĩ״���壬������ˮ�����ȵ�һ���¶ȿɷֽ�Ϊ��ˮ�
�ش��������⣺
��1��д��Mg2B2O5��H2O�����ᷴӦ�Ļ�ѧ����ʽ___��Ϊ��߽������ʣ����ʵ���������Ũ��Ũ���⣬���ɲ�ȡ�Ĵ�ʩ�У�д��������___��
��2�����������л�ʣ��������ǣ�___��д��ѧʽ����
��3�����������������ȼ�H2O2��Һ��������___��Ȼ���ٵ�����Һ��pHԼΪ5��Ŀ����___��
��4�������������е���Ҫ������___�������ƣ���
��5����������������ɾ������������������֡�������ͽ���þΪԭ�Ͽ��Ʊ��������û�ѧ����ʽ��ʾ�Ʊ�����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ����Cl2+2KBr=2KCl+Br2 ��KClO3+6HCl=3Cl2+KCl+3H2O �� 2KBrO3+Cl2=Br2+2KClO3������˵����ȷ��
A.����������Ӧ���е������ɣ����Զ����û���Ӧ
B.��Ӧ���л�ԭ���������������ʵ���֮��Ϊ6��1
C.��Ӧ����1mol Cl2��Ӧ�����������õ��ӵ����ʵ���Ϊ10mol
D.��������ǿ������˳��Ϊ��KClO3>KBrO3>Cl2>Br2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ���г���ʵ����������Ҫ��ش����⣺
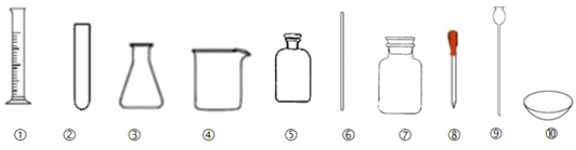
��1��ָ�������۵����ƣ�__��Ϊ�������ܷ���������ʱ����Һ��ҩƷ����ѡ�õ�������___�������ƣ���
��2��ʢ�Ź���ҩƷ��Ӧ������__������ţ���
��3���ܹ�ֱ�Ӽ��ȵ�������__������ţ���
��4���ܽ�϶�����ʳ��Ӧѡ�õ������ܺ͢ޣ������������ڴ�ʵ���е�������__��
��5����ȡ18mLˮӦѡ�õ�����___������ţ�������ʱ����Ҫ��Һ��__����18mLˮ������һЩ�����Ӷ�����10mL����������ʵ�����___�������ڡ���С�ڡ���8mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ������ɹ��ϳ������������嵪��������(N5)6(H3O)3(NH4)4Cl(��R����)����X����������R�ľֲ��ṹ��ͼ��ʾ������˵����ȷ���ǣ� ��
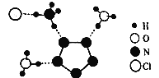
A.R�����������ӵ�����ԭ�ӵ��ӻ����������ͬ������ѧ�����Ͳ�ͬ
B.1molR����������Ϊ15��
C.N5-�в����γɵĴ�����������Ϊ6��
D.��֪ͼ�����ߴ������������һ����ʾΪ��NH4��N��H������Cl������R�й���4����ͬ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ը�����(��Ҫ�ɷ�ΪTi3O5��������SiO2��FeO��Fe2O3)Ϊԭ���Ʊ���ɫ����TiO2��һ�ֹ����������£�

��֪��Na2TiO3�����ڼ�����Һ��H2TiO3�е�����Fe2����Fe3������ˮϴ��ȥ��
(1)����:
��Ϊ�ӿ췴Ӧ���ʣ���ά�ַ�Ӧ�������С����Ӧ�¶�һ���������£��ɲ�ȡ�Ĵ�ʩ��__________��
��NaOH������Ti3O5�ڿ����м�����500��550 ��ʱ����Na2TiO3���÷�Ӧ�Ļ�ѧ����ʽΪ_________��
(2)����:
�١���Һ������Ҫ����ΪNaOH������������________(�ѧʽ)��
�ڳ��Ӻ����Һ�л�õ�NaOH��ѭ�����ã���ˮ����ʱ����ˮ�����˹������Ҫԭ����_________��
(3)ˮ��:�����ܡ����õ�TiOSO4��������У�����������ˮ��H2TiO3���÷�Ӧ�Ļ�ѧ����ʽΪ______��
(4)��ɫ:H2TiO3�����������Fe(OH)3��Ӱ��TiO2��Ʒ����ɫ������ɫ��������Ti2(SO4)3��������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ��
��![]() ��
��![]() ��Ϊ����������Ԫ�أ�
��Ϊ����������Ԫ�أ�![]() ��
��![]() ����ͬһ���ڣ�
����ͬһ���ڣ�![]() ��
��![]() ����ͼ����ӷֱ�Ϊ
����ͼ����ӷֱ�Ϊ![]() ��
��![]() ��
��![]() ��
��![]() ������ͬ�ĵ��Ӳ�ṹ������˵����ȷ���ǣ� ��
������ͬ�ĵ��Ӳ�ṹ������˵����ȷ���ǣ� ��
A.ԭ�ӵ�������������![]()
B.�����ӻ�ԭ�ԣ�![]()
C.���Ӱ뾶��![]()
D.ԭ��������![]()
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com