
某学生用0.10 mol/L标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
|
实验序号 |
待测液体积(mL) |
所消耗NaOH标准液的体积(mL) |
|
|
滴定前 |
滴定后 |
||
|
1 |
20.00 |
0.50 |
20.54 |
|
2 |
20.00 |
6.00 |
26.00 |
|
3 |
20.00 |
1.40 |
21.36 |
(1)滴定时选用酚酞试液作指示剂,如何判断滴定达到终点 。
(2)盐酸的物质的量浓度为_____________
(3)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是 (填“偏高”或“偏低”或“无影响”,下同)。
(4)某同学用已知准确浓度的高锰酸钾溶液滴定溶液中Fe2+的浓度,高锰酸钾溶液应盛放在 中(填“甲”或“乙”),该反应的离子方程式为: 。

(1)当滴入最后一滴标准液,溶液由无色变为浅红色,且半分钟内不退色
(2)0.10mol/L (3) 偏高(4) 甲 5Fe2+ + MnO4- + 8H+ = 5Fe2+ + Mn2+ + 4H2O
【解析】
试题分析:(1)因为这是由已知浓度的碱滴定未知浓度的酸,酚酞指示剂在酸溶液中,是无色的,随着碱的滴加,溶液的酸性逐渐减弱,当滴加到最后一滴时,溶液由无色变为浅红色,半分钟内不褪色时酸碱中和恰好完成。(2)碱溶液的平均体积为V=(V1+V2+V3)÷3= ((20.54-0.05)+(26.00-6.00) +(21.36-1.40)) ÷3=20.00ml,利用酸碱恰好发生中和反应时C酸••V酸=C碱•V碱,C酸=( C碱•V碱) ÷V酸=(0.10 mol/L×20.00ml) ÷20.00ml=0.10mol/L. (3)若在滴定前碱式滴定管尖嘴部分有气泡,滴定后消失,碱溶液的体积偏大,以此为标准计算的酸的浓度偏高。(4)若用已知准确浓度的高锰酸钾溶液滴定溶液中Fe2+的浓度,由于高锰酸钾溶液有强的氧化性,容易腐蚀碱式滴定管的橡胶管,所以应盛放在酸式滴定管甲中,发生该反应的离子方程式为5Fe2+ + MnO4- + 8H+ = 5Fe2+ + Mn2+ + 4H2O。
考点:考查滴定法的应用、酸碱中和滴定终点的判断、误差分析等知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
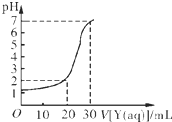 某学生用NaOH标准溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用NaOH标准溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:| A | B | C | D | |
| X/mol?L-1 | 0.09 | 0.03 | 0.9 | 0.3 |
| Y/mol?L-1 | 0.03 | 0.09 | 0.3 | 0.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
Ⅰ.下图为常见仪器的部分结构(有的仪器被放大)
图A中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为n mL,仰视时读数为m mL,若m>n,则所使用的仪器是 (填字母标号)。
Ⅱ.某学生用标准0.25 mol·L—1 NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。 C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。 F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终? 。
④碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) ,原因是 。
⑤假设操作均正确,标准液消耗了22.18mL,计算待测硫酸溶液的物质的量浓度(计算结果精确到小数点后二位) mol·L—1
Ⅲ.已知常温时醋酸的电离常数为1.8×10-5,一水合氨的电离常数为1.8×10-5。在少量Mg(OH)2悬浊液中,滴加适量饱和NH4Cl溶液,固体溶解。对于固体的溶解。
甲同学认为在氢氧化镁悬浊液中存在下列平衡:
Mg(OH)2 Mg2+ +2OH-
加入NH4Cl溶液,由于NH4+水解产生H+中和了Mg(OH)2电离产生的OH-而使平衡右移导致Mg(OH)2 溶解。
而乙同学却认为NH4Cl电离产生的NH4+结合了OH-生成了弱电解质NH3·H2O,使c(OH-)减小,平衡右移而导致Mg(OH)2 溶解。设计方案评价甲乙两位同学的观点:
_____________________________________ ______________________________
_________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源:2010年浙江省温州二中高二第二学期期中考试化学试题 题型:实验题
Ⅰ.下图为常见仪器的部分结构(有的仪器被放大)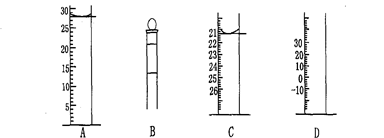
图A中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为n mL,仰视时读数为m mL,若m>n,则所使用的仪器是 (填字母标号)。
Ⅱ.某学生用标准0.25 mol·L—1 NaOH溶液滴定硫酸的实验操作如下:
| A.用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂。 | |
| B.用待测定的溶液润洗酸式滴定管。 | C.用蒸馏水洗干净滴定管。 |
| D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。 |
 Mg2+ +2OH-
Mg2+ +2OH-查看答案和解析>>
科目:高中化学 来源:2010年浙江省高二第二学期期中考试化学试题 题型:实验题
Ⅰ.下图为常见仪器的部分结构(有的仪器被放大)
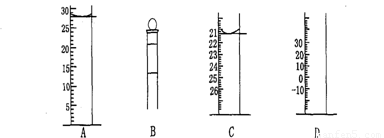
图A中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为n mL,仰视时读数为m mL,若m>n,则所使用的仪器是 (填字母标号)。
Ⅱ.某学生用标准0.25 mol·L—1 NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。 C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。 F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终? 。
④碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) ,原因是 。
⑤假设操作均正确,标准液消耗了22.18mL,计算待测硫酸溶液的物质的量浓度(计算结果精确到小数点后二位) mol·L—1
Ⅲ.已知常温时醋酸的电离常数为1.8×10-5,一水合氨的电离常数为1.8×10-5。在少量Mg(OH)2悬浊液中,滴加适量饱和NH4Cl溶液,固体溶解。对于固体的溶解。
甲同学认为在氢氧化镁悬浊液中存在下列平衡:
Mg(OH)2  Mg2+ +2OH-
Mg2+ +2OH-
加入NH4Cl溶液,由于NH4+水解产生H+中和了Mg(OH)2电离产生的OH-而使平衡右移导致Mg(OH)2 溶解。
而乙同学却认为NH4Cl电离产生的NH4+结合了OH-生成了弱电解质NH3·H2O,使c(OH-)减小,平衡右移而导致Mg(OH)2 溶解。设计方案评价甲乙两位同学的观点:
_____________________________________ ______________________________
_________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
Ⅰ.下图为常见仪器的部分结构(有的仪器被放大)
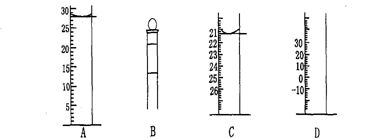
图A中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为n mL,仰视时读数为m mL,若m>n,则所使用的仪器是 (填字母标号)。
Ⅱ.某学生用标准0.25 mol·L—1 NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。 C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。 F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终? 。
④碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) ,原因是 。
⑤假设操作均正确,标准液消耗了22.18mL,计算待测硫酸溶液的物质的量浓度(计算结果精确到小数点后二位) mol·L—1
Ⅲ.已知常温时醋酸的电离常数为1.8×10-5,一水合氨的电离常数为1.8×10-5。在少量Mg(OH)2悬浊液中,滴加适量饱和NH4Cl溶液,固体溶解。对于固体的溶解。
甲同学认为在氢氧化镁悬浊液中存在下列平衡:
Mg(OH)2 ![]() Mg2+ +2OH-
Mg2+ +2OH-
加入NH4Cl溶液,由于NH4+水解产生H+中和了Mg(OH)2电离产生的OH-而使平衡右移导致Mg(OH)2 溶解。
而乙同学却认为NH4Cl电离产生的NH4+结合了OH-生成了弱电解质NH3·H2O,使c(OH-)减小,平衡右移而导致Mg(OH)2 溶解。设计方案评价甲乙两位同学的观点:
_____________________________________ ______________________________
_________________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com