
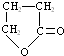
 ,化合物C的结构简式是HOCH2CH=CHCOONa.
,化合物C的结构简式是HOCH2CH=CHCOONa. .
. 分析 A是一种直链一溴代物,能与银氨溶液发生氧化反应,则A含有醛基,B转化得到C,C酸化得到D,故D中含有羧基,D与氢气发生加成反应生成E,E再浓硫酸作用下生成F,且F是环状化合物,环上有5个原子,其化学式为C4H6O2,F应属于酯类,故F为 ,1mol A与2mol H2反应生成1molG,故A分子好还含有1个碳碳双键,结合F的结构可知,A为BrCH2CH=CHCHO,故B为BrCH2CH=CHCOONH4,反应②中应是卤代烃的在氢氧化钠水溶液、加热条件下发生的水解反应,故C为HOCH2CH=CHCOONa,则D为HOCH2CH=CHCOOH,E为BrCH2CH2CH2COOH,A与氢气发生加成反应生成G为BrCH2CH2CH2CH2OH,据此解答.
,1mol A与2mol H2反应生成1molG,故A分子好还含有1个碳碳双键,结合F的结构可知,A为BrCH2CH=CHCHO,故B为BrCH2CH=CHCOONH4,反应②中应是卤代烃的在氢氧化钠水溶液、加热条件下发生的水解反应,故C为HOCH2CH=CHCOONa,则D为HOCH2CH=CHCOOH,E为BrCH2CH2CH2COOH,A与氢气发生加成反应生成G为BrCH2CH2CH2CH2OH,据此解答.
解答 解:A是一种直链一溴代物,能与银氨溶液发生氧化反应,则A含有醛基,B转化得到C,C酸化得到D,故D中含有羧基,D与氢气发生加成反应生成E,E再浓硫酸作用下生成F,且F是环状化合物,环上有5个原子,其化学式为C4H6O2,F应属于酯类,故F为 ,1mol A与2mol H2反应生成1molG,故A分子好还含有1个碳碳双键,结合F的结构可知,A为BrCH2CH=CHCHO,故B为BrCH2CH=CHCOONH4,反应②中应是卤代烃的在氢氧化钠水溶液、加热条件下发生的水解反应,故C为HOCH2CH=CHCOONa,则D为HOCH2CH=CHCOOH,E为BrCH2CH2CH2COOH,A与氢气发生加成反应生成G为BrCH2CH2CH2CH2OH,
,1mol A与2mol H2反应生成1molG,故A分子好还含有1个碳碳双键,结合F的结构可知,A为BrCH2CH=CHCHO,故B为BrCH2CH=CHCOONH4,反应②中应是卤代烃的在氢氧化钠水溶液、加热条件下发生的水解反应,故C为HOCH2CH=CHCOONa,则D为HOCH2CH=CHCOOH,E为BrCH2CH2CH2COOH,A与氢气发生加成反应生成G为BrCH2CH2CH2CH2OH,
(1)由上述分析可知,化合物F的结构简式是 ,C为HOCH2CH=CHCOONa,故答案为:
,C为HOCH2CH=CHCOONa,故答案为: ;HOCH2CH=CHCOONa;
;HOCH2CH=CHCOONa;
(2)A为BrCH2CH=CHCHO,含有醛基、溴原子、碳碳双键,故答案为:醛基、溴原子、碳碳双键;
(3)1mol A与2mol G反应的化学方程式是:BrCH2CH=CHCHO+2H2$\stackrel{催化剂}{→}$BrCH2CH2CH2CH2OH,
故答案为:BrCH2CH=CHCHO+2H2$\stackrel{催化剂}{→}$BrCH2CH2CH2CH2OH;
(4)D为HOCH2CH=CHCOOH,含有碳碳双键,能够发生加聚反应,化学方程式为 ,
,
故答案为 .
.
点评 本题考查有机物推断,综合分析确定F的结构是关键,再结合转化关系进行推断,侧重考查学生分析推理能力,需要学生熟练掌握官能团的性质与转化,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 1:1 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HSO4溶液中加入少量NaOH稀溶液:NH4++OH-=NH3•H2O | |
| B. | Ca(ClO)2溶液中通入过量的二氧化硫气体:ClO-+SO2+H2O=HClO+HSO3- | |
| C. | 酸性高锰酸钾溶液中滴入少量过氧化氢:2MnO4-+7H2O2+6H+=2Mn2++6O2↑+10H2O | |
| D. | 为缓解胃酸过多,服含NaHCO3的抗酸药:HCO3-+H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L 的HCl | B. | 0.5mol/L 的CH3COOH | ||
| C. | 蒸馏水 | D. | 0.5mol/L 的氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合价 | 甲 | 乙 | 丙 |
| 元素种类 | A、B | A、C | C、D |
 ,丙中阴离子与阳离子的个数比为1:2
,丙中阴离子与阳离子的个数比为1:2查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com