
分析 氯化铁水解生成氢氧化铁和氯化氢,向沸水中滴入饱和氯化铁溶液,加热至红褐色得到分散系氢氧化铁胶体;向Fe(OH)3胶体中滴入稀盐酸,先发生胶体的聚沉,然后二者之间会发生复分解反应,氢氧化铁与盐酸发生酸碱中和反应生成氯化铁和水.
解答 解:氯化铁水解生成氢氧化铁和氯化氢,化学方程式:FeCl3+3H2O═Fe(OH)3(胶体)+3HCl;氢氧化铁与盐酸发生酸碱中和反应生成氯化铁和水,离子方程式:Fe(OH)3+3H+═Fe3++3H2O;
故答案为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl; Fe(OH)3+3H+═Fe3++3H2O.
点评 本题考查学生Fe(OH)3胶体的性质、制备等知识,注意知识的迁移和应用是解题关键,难度不大.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:选择题
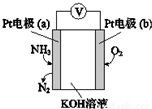
| A. | 该传感器在工作过程中KOH的物质的量不变 | |
| B. | a极的电极反应式为2NH3+3O2--6e-═N2+3H2O | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| D. | b极为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 制备收集CO2:连接b→d→e | B. | 制备收集H2:连接b→c→g | ||
| C. | 制备收集NH3:连接b→d→e→c | D. | 制备收集Cl2:连接a→f→c→e→d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | HA物质的量 浓度/(mol•L-1) | NaOH物质的量 浓度/(mol•L-1) | 混合后溶 液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
| 丁 | 0.1 | 0.1 | pH=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.6NA | |
| B. | 常温常压下,92g的NO2和N2O4的混合气体中含有的原子个数为6 NA | |
| C. | 用惰性电极电解食盐水,若电路中通过NA个电子,则阳极产生的气体体积一定为11.2L | |
| D. | 2.0gH218O与D2O的混合物中所含中子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
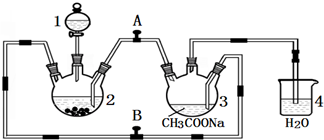
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
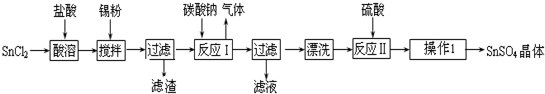
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在反应CaH2+2H2O═Ca(OH)2+2H2↑中,水作氧化剂 | |
| B. | 根据反应Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑可推出Cu的还原性比H2的强 | |
| C. | 反应3NO2+H2O═2HNO3+NO中氧化剂和还原剂的物质的量之比是3:1 | |
| D. | 因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
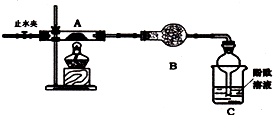

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com