
| A. | 1 mol甲苯与3 mol H2发生加成反应 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色生成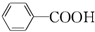 | |
| C. | 甲苯燃烧产生带浓烟的火焰 | |
| D. | 甲苯与浓硝酸反应生成三硝基甲苯 |
分析 侧链对苯环有影响,使苯环变得活泼,更容易发生取代反应,所以甲苯硝化时能生成三硝基甲苯.
解答 解:A、1mol甲苯或1mol苯都能与3molH2发生加成反应,所以不能说明侧链对苯环有影响,故A错误;
B、烷烃中的甲基不能被高锰酸钾溶液氧化,而甲苯中的甲基可以被高锰酸钾氧化为苯甲酸,这说明苯环使侧链活化,而不能体现侧链对苯环的影响,故B错误;
C、苯和甲苯都能燃烧产生带浓烟的火焰,这是由于碳的百分含量较高、碳不完全燃烧导致,所以不能说明侧链对苯环有影响,故C错误;
D、甲苯和苯都能与浓硝酸、浓硫酸发生取代反应,但产物不同,侧链对苯环有影响,使苯环变得活泼,更容易发生取代反应,甲苯硝化生成三硝基甲苯,能说明侧链对苯环有影响,故D正确.
故选D.
点评 本题以侧链对苯环的影响为载体考查了苯的同系物的化学性质,难度不大,注意:苯环对甲基的影响导致甲苯能被酸性高锰酸钾氧化成甲酸,而同时苯环对侧链也有影响甲苯能使酸性高锰酸钾褪色.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯分子中碳碳键为单双键交替结构 | |
| B. | 苯中含有碳碳双键,所以苯属于烯烃 | |
| C. | 苯与氢气在一定条件下反应生成环己烷 | |
| D. | 苯可以与溴水反应而使其褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B2)=0.8 mol/(L•s) | B. | v(A2)=0.5 mol/(L•s) | C. | v(C)=0.9 mol/(L•s) | D. | v(B2)=1.2 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物 干冰 SO2 | B. | 碱 苛性钠 NaOH | ||
| C. | 盐 钡餐 BaCO3 | D. | 单质 氯水 Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
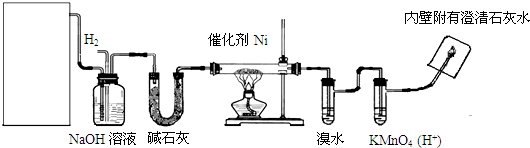
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
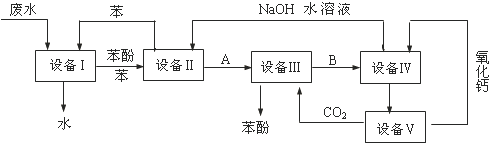
| A. | 上述流程里,设备Ⅰ、Ⅱ中进行的是分液操作;实验室里该操作可以用分液漏斗进行 | |
| B. | 上述流程里,设备Ⅲ、Ⅳ中进行的是过滤操作;实验室里该操作用到的玻璃仪器有:漏斗、烧杯、玻璃棒 | |
| C. | 在设备Ⅲ中发生反应的化学方程式为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3 | |
| D. | 图中循环使用的物质是C6H6、CaO、CO2和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
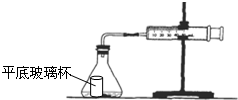 盐酸与碳酸钙反应生成CO2,运用如图,通过测量一定时间内产生CO2气体的体积,可测定该反应的速率.室温是29.5℃.请根据要求填空:
盐酸与碳酸钙反应生成CO2,运用如图,通过测量一定时间内产生CO2气体的体积,可测定该反应的速率.室温是29.5℃.请根据要求填空:| 时间/s | 10 | 20 | 30 | 40 | 50 | 60 |
| 气体体积/mL | 4 | 14 | 25 | 38 | 47 | 55 |
| 反应速率/mL•s-1 | 0.4 | 1.0 | 1.1 | 1.3 | 0.9 | 0.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com