
随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.
①有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9 kJ/mol
由上述方程式可知,CH3OH的燃烧热________(填“大于”、“等于”或“小于”)192.9 kJ/mol.已知水的气化热为44 kJ/mol,则氢气燃烧热的热化学方程式为________.
②下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图.甲醇在催化剂作用下提供质子和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O.则c电极是________(填“正极”或“负极”),c电极上发生的电极反应是________.
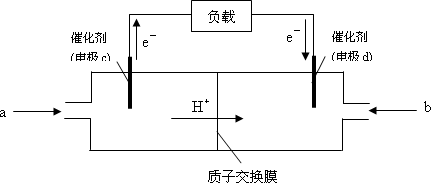
科目:高中化学 来源: 题型:
 (2011?湖南二模)(1)已知可逆反应:M(g)+N(g)
(2011?湖南二模)(1)已知可逆反应:M(g)+N(g) P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
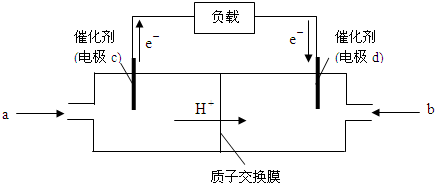
查看答案和解析>>
科目:高中化学 来源:2012届福建省芗城三校高三下学期第二次考试化学试卷(带解析) 题型:填空题
(共10分)
(1)已知可逆反应:M(g)+N(g) P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为_______________。
| A.加入一定量M | B.加入一定量N |
| C.反应温度升高 | D.缩小容器体积 |

查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省芗城三校高三下学期第二次考试化学试卷(解析版) 题型:填空题
(共10分)
(1)已知可逆反应:M(g)+N(g) P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为_______________。
A.加入一定量M B.加入一定量N C.反应温度升高
D.缩小容器体积 E.加入某物质作催化剂 F.分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为_______________。此反应的化学平衡常数K=_______________。
③若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=_______________mol·L-1。
(2)随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求。
下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。甲醇在催化剂作用下提供质子和电子(电子转移的方向如下图所示),电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH+3O2===2CO2+4H2O。则c电极是 (填“正极”或“负极”),c电极上发生的电极反应式为_____________________________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com