
【题目】某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母): 。
名称 | 托盘天平 | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。

(1)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol-1) 。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
温度 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.6 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①上表中的温度差平均值为 ℃
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c="4.18" J·(g·℃)-1。则中和热ΔH= (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【答案】Ⅰ.(1)5.0(1分)
(2)a、b、e(2分)
Ⅱ.(1)1/2H2SO4(aq)+ NaOH(aq)1/2Na2SO4(aq)+ H2O(l) ΔH="-57.3" kJ·mol-1(2分)
(2)①4.0(2分) ②-53.5 kJ·mol-1(2分) ③a、c、d(2分)
【解析】试题分析:Ⅰ.(1)需要称量NaOH固体m=nM=cVM=0.5mol/L×0.5L×40g/mol=5.0g。
(2)氢氧化钠要在称量瓶或者小烧杯中称量,称量固体氢氧化钠所用的仪器有天平、烧杯和药匙,故答案为:a b e 。
Ⅱ.(1)中和热为酸碱中和生成1mol H2O时的焓变,所以表示稀硫酸和稀氢氧化钠中和热的热化学方程式为:1/2H2SO4(aq)+ NaOH(aq)=1/2Na2SO4(aq)+ H2O(l) ΔH="-57.3" kJ·mol-1
(2)①第2组数据明显有误,所以删掉,其它三组数据求平均值,温度差平均值=【(30.126.1)+(29.825.9)+(30.426.3)】÷3=4.0°C。
②50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80ml×1g/ml=80g,温度变化的值为△T=4℃,则生成0.025mol水放出的热量为Q=mc△T=80g×4.18J/(g℃)×4.0℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=-1.3376kJ÷0.025mol=--53.5 kJ·mol-1。
③a、实验装置保温、隔热效果必须好,否则影响实验结果,正确;b、量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,则大于57.3kJ/mol,错误;c、尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,正确;d、用温度计测定NaOH溶液起始温度后,要将温度计回零直再测定H2SO4溶液的温度,正确。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】下列叙述不正确的( )
A.金属材料分为黑色金属材料和有色金属材料
B.活泼金属在空气中易与氧气反应,表面生成一层氧化膜均能保护内层金属
C.硅是一种亲氧元素,在自然界中它总是与氧相互化合的
D.氯是最重要的“成盐元素”,主要以NaCl的形成存在于海水和陆地的盐矿中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《天工开物》中的《燔石》篇载有:“百里内外,土中必生可燔石……掘取受燔……火力到后,烧酥石性,置于风中久自吹化成粉。急用者以水沃之,亦自解散……用以砌墙石,则筛去石块,水调粘合。”其中不涉及的物质是
A. 石膏 B. 石灰石 C. 熟石灰 D. 生石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应:X(g)+3Y(g)2Z(g)平衡常数与温度关系如下表所示:
温度(℃) | 360 | 440 | 520 |
K | 0.036 | 0.010 | 0.0038 |
(1)根据上述数据判断,该可逆反应的正反应是________(填“吸热”或“放热”)反应,理由是__________________________。
(2)为了增大X的转化率和反应速率,宜采用的措施是____
A.升高温度 B.增大压强
C.加催化剂 D.离Z
(3)在2 L密闭容器中充入Z气体,在一定条件下进行反应。下列图象不能表明该反应达到平衡状态的是________。




(4)440 ℃时,在2 L密闭容器中,开始充入1 mol X气体和3 mol Y气体进行反应。在某时刻测得c(X)=0.45 mol·L-1,此时,反应是否达到平衡状态________(填“是”或“否”),简述理由:___________________________________。
(5)在某容积固定的容器中进行上述反应,当X、Y起始物质的量一定时,仅改变一个外界条件对Z体积分数的影响如图所示(曲线Ⅰ为标准):

①曲线Ⅱ改变的条件是_______________________________。
② 曲线Ⅲ改变的条件是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某蛋白质分子的结构示意图,图中α链由21个氨基酸组成,β链由19个氨基酸组成,图中“-S-S-”是在蛋白质加工过程中由两个“-SH”脱下2个H形成的。下列有关叙述中,错误的是( )
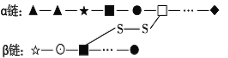
A.蛋白质多样性的原因包括氨基酸的排列顺序不同
B.该蛋白质含有40种氨基酸
C.该蛋白质分子中至少含有42个O原子
D.形成该蛋白质分子时相对分子质量减少了686
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应A+B![]() AB来说,常温下按以下情况进行反应:
AB来说,常温下按以下情况进行反应:
①20 mL溶液中含A、B各0.01 mol ②50 mL溶液中含A、B各0.05 mol
③0.1 mol·L-1的A、B溶液各10 mL ④0.5 mol·L-1的A、B溶液各50 mL
四者反应速率的大小关系是 ( )
A. ②>①>④>③ B. ④>③>②>① C. ①>②>④>③ D. ①>②>③>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鉴定尿中是否有蛋白质常用加热法来检验。下图为蛋白质加热过程中的变化,据此判断下列有关叙述正确的是 ( )

A.沸水浴加热后,构成蛋白质的肽链充分伸展并断裂
B.变性后的蛋白质可与双缩脲试剂产生紫色反应
C.蛋白质加热过程中,氨基酸的排列顺序会发生改变
D.蛋白质肽链的盘曲和折叠被解开后,其特定功能并未发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》对白酒(俗称烧酒)的制造过程有如下叙述:“烧酒非古法也,自元时创始,其法用浓酒和糟入甑,蒸令气上,用器承滴露”,“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……价值数倍也”。文中涉及的操作方法是( )
A. 干馏 B. 蒸发 C. 蒸馏 D. 升华
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com