
【题目】工厂中用稀硫酸浸泡某矿石后的溶液中,除了含有大量硫酸外,还含有少量NH![]() 、Fe3+、AsO
、Fe3+、AsO![]() 、Cl-。为除去杂质离子,部分操作流程如下:
、Cl-。为除去杂质离子,部分操作流程如下:
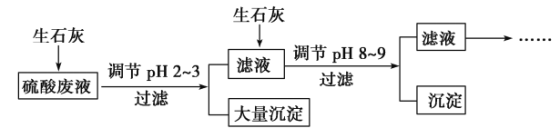
请回答问题:
(1)用稀硫酸浸泡某矿石后的溶液中,硫酸的浓度为4.9 g·L-1,则该溶液中的pH约为_____________________________。
(2)NH![]() 在用稀硫酸浸泡某矿石后的溶液中以(NH4)2SO4和NH4Cl形式存在。现有一份(NH4)2SO4溶液,一份NH4Cl溶液,(NH4)2SO4溶液中c(NH
在用稀硫酸浸泡某矿石后的溶液中以(NH4)2SO4和NH4Cl形式存在。现有一份(NH4)2SO4溶液,一份NH4Cl溶液,(NH4)2SO4溶液中c(NH![]() )恰好是NH4Cl溶液中c(NH
)恰好是NH4Cl溶液中c(NH![]() )的2倍,则c[(NH4)2SO4]__________c(NH4Cl)(填“<”“=”或“>”)。
)的2倍,则c[(NH4)2SO4]__________c(NH4Cl)(填“<”“=”或“>”)。
(3)随着向废液中投入生石灰(忽略溶液温度的变化),溶液中![]() __________(填“增大”“减小”或“不变”)。
__________(填“增大”“减小”或“不变”)。
(4)投入生石灰调节pH到2~3时,大量沉淀主要成分为CaSO4·2H2O[含有少量Fe(OH)3],提纯CaSO4·2H2O的主要操作步骤:向沉淀中加入过量________,充分反应后,过滤、洗涤、__________________________。
(5)25 ℃,H3AsO4电离常数为K1=5.6×10-3,K2=1.7×10-7,K3=4.0×10-12。当溶液中pH调节到8~9时,沉淀主要成分为Ca3(AsO4)2。
①pH调节到8左右Ca3(AsO4)2才开始沉淀的原因是_____________________。
②Na3AsO4第一步水解的平衡常数数值为___________________。
③已知:AsO![]() +2I-+2H+===AsO
+2I-+2H+===AsO![]() +I2+H2O,SO2+I2+2H2O===SO
+I2+H2O,SO2+I2+2H2O===SO![]() +2I-+4H+。上述两个反应中还原性最强的微粒是__________。
+2I-+4H+。上述两个反应中还原性最强的微粒是__________。
【答案】(1)1
(2)<
(3)减小
(4)稀硫酸 晾干或干燥
(5)①H3AsO4是弱酸,当溶液中pH调节到8左右,c(AsO![]() )增大,Ca3(AsO4)2开始沉淀
)增大,Ca3(AsO4)2开始沉淀
②2.5×10-3
③SO2
【解析】硫酸废液中含有大量硫酸外,还含有少量NH![]() 、Fe3+、AsO
、Fe3+、AsO![]() 、Cl-,加入生石灰,调节pH 2~3,大量沉淀主要成分为CaSO4·2H2O[含有少量Fe(OH)3],滤液加入生石灰调节pH 8~9,生成Ca3(AsO4)2沉淀,滤液主要含有(NH4)2SO4和NH4Cl。
、Cl-,加入生石灰,调节pH 2~3,大量沉淀主要成分为CaSO4·2H2O[含有少量Fe(OH)3],滤液加入生石灰调节pH 8~9,生成Ca3(AsO4)2沉淀,滤液主要含有(NH4)2SO4和NH4Cl。
(1)硫酸的浓度为4.9g·L-1,c(H2SO4)=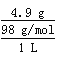 =0.0 5mol/L,c(H+)=0. 1mol/L,pH=-lg0.1=1。
=0.0 5mol/L,c(H+)=0. 1mol/L,pH=-lg0.1=1。
(2)如c[(NH4)2SO4]=c(NH4Cl),则(NH4)2SO4溶液中c(NH![]() )较大,因c(NH
)较大,因c(NH![]() )越大,NH
)越大,NH![]() 水解程度越小,则(NH4)2SO4溶液中c(NH
水解程度越小,则(NH4)2SO4溶液中c(NH![]() )小于NH4Cl溶液中c(NH
)小于NH4Cl溶液中c(NH![]() )的2倍,如等于2倍,则c(NH4Cl)应较大。
)的2倍,如等于2倍,则c(NH4Cl)应较大。
(3)随着向废液中投入生石灰,c(OH-)增大,c(NH3·H2O)减小,则溶液中![]() 减小。
减小。
(4)提纯CaSO4·2H2O,可加入稀硫酸溶解Fe(OH)3,且防止CaSO4·2H2O的溶解,过滤后洗涤、干燥。
(5)①H3AsO4是弱酸电离出来的AsO![]() 较少,所以酸性条件下不易形成Ca3(AsO4)2沉淀,当溶液中pH调节到8左右时AsO
较少,所以酸性条件下不易形成Ca3(AsO4)2沉淀,当溶液中pH调节到8左右时AsO![]() 浓度增大,Ca3(AsO4)2开始沉淀。②Na3AsO4的第一步水解的离子方程式为AsO
浓度增大,Ca3(AsO4)2开始沉淀。②Na3AsO4的第一步水解的离子方程式为AsO![]() +H2OHAsO
+H2OHAsO![]() +OH-,该步水解的平衡常数Kh=
+OH-,该步水解的平衡常数Kh=![]() =
=![]() =
=![]() =
=![]() =2.5×10-3。
=2.5×10-3。
③已知:AsO![]() +2I-+2H+===AsO
+2I-+2H+===AsO![]() +I2+H2O,SO2+I2+2H2O===SO
+I2+H2O,SO2+I2+2H2O===SO![]() +2I-+4H+。还原剂还原性大于还原产物的还原性,则还原性SO2>I->AsO
+2I-+4H+。还原剂还原性大于还原产物的还原性,则还原性SO2>I->AsO![]() ,两个反应中还原性最强的微粒是SO2。
,两个反应中还原性最强的微粒是SO2。


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】某化学小组同学向一定量加入少量淀粉的NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色。
(1)查阅资料知,NaHSO3与过量KIO3反应分为两步进行,第一步为IO![]() +3HSO
+3HSO![]() ===3SO
===3SO![]() +3H++I-,则第二步反应的离子方程式为________________________。
+3H++I-,则第二步反应的离子方程式为________________________。
(2)通过测定溶液变蓝所用时间探究浓度和温度对该反应的反应速率的影响。调节反应物浓度和温度进行对比实验,记录如下:
实验编号 | 0.02 mol/L NaHSO3溶液/mL | 0.02 mol/L KIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
① | 15 | 20 | 10 | 15 | t1 |
② | a | 30 | 0 | 15 | t2 |
③ | 15 | b | c | 30 | t3 |
实验①②是探究____________对反应速率的影响,表中a=________;实验①③是探究温度对反应速率的影响,则表中b=________,c=________。
(3)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小。课题组对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设三:
假设一:反应生成的SO![]() 对反应起催化作用,SO
对反应起催化作用,SO![]() 浓度越大反应速率越快;
浓度越大反应速率越快;
假设二:反应生成的H+对反应起催化作用,H+浓度越大反应速率越快;
假设三:__________________________;
……
(4)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定)。
实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于氧化还原反应同时又是吸热反应的是
A.Ba(OH)2·8H2O与NH4Cl反应
B.铝与稀盐酸
C.灼热的炭与水蒸气生成一氧化碳和氢气的反应
D.煤与O2的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方案能达到实验目的的是
A. 为了快速得到氨气以演示喷泉实验,我们可以用加热NH4Cl固体的方法来制取氨气
B. 用乙醇萃取溴水中的溴单质
C. 氮气中混有的少量氧气可以通过灼热的铜网来除去
D. 用酸性高锰酸钾溶液除去乙烷中混有的少量乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.1mol任何气体的体积都约是22.4L
B.lmolH2和O2的混合气体,在标准状况下的体积约为22.4L
C.lmol H2气态物质,当体积为22.4L时,该气体一定处于标准状况
D.标准状况下,2molH2O体积约为44.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 锌与稀硝酸反应: Zn+2H+===Zn2++H2↑
B. Al2O3与少量NaOH溶液反应:Al3++3OH- =Al(OH)3↓
C. 碳酸氢钠溶液与氢氧化钠溶液反应:H++OH-=H2O
D. 向偏铝酸钠溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述中,正确的是( )
A.12.0 g NaHSO4晶体中阳离子和阴离子的总数为0.3NA
B.14 g分子式为CnH2n的链烃中含有的碳碳双键的数目一定为NA/n
C.标准状况下,1 L液态水中含有的H+数目为10-7NA
D.足量Zn与一定量的浓硫酸反应,产生22.4 L气体时,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)向某NaOH溶液中投入一块Al箔,先无明显现象,随后逐渐产生气泡,则产生气泡的离子反应方程式为______。
(2)实验室常用还原性Fe粉与水蒸气反应的实验来研究Fe的还原性,则该反应的化学反应方程式为______
(3)Fe(OH)2制备时,采用的方法是“长滴管、液面下”的实验操作,但在实验时,由于操作不当,依旧会出现白色沉淀、灰绿色沉淀直至最终变为红褐色沉淀,写出白色沉淀最终转化为红褐色沉淀的化学反应方程式为______
(4)实验时制备Al(OH)3时,常用可溶性铝盐(如Al2(SO4)3与氨水反应进行制备。某课外小组在实验时不慎向Al2(SO4)3溶液中加入了过量NaOH溶液,最终并没有制出白色沉淀Al(OH)3,则该小组同学实验时发生的总离子反应方程式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com