


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
| A、c(CH3COO-)>c(H+)>c(Na+ )>c(OH-) |
| B、c(Na+ )>c(OH-)>c(CH3COO-)>c(H+ ) |
| C、c(OH-)>c(Na+ )>c(H+ )>c(CH3COO-) |
| D、c(Na+ )>c(CH3COO-)>c(OH-)>c(H+ ) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 压强 SO2转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
| 10 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
| B | 浓氨水 | 碱石灰 | AgNO3溶液 | AgOH具有两性 | |
| C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
| D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:C>Si |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等于1.12L |
| B、等于0.56L |
| C、大于1.12L |
| D、小于1.12L |
查看答案和解析>>
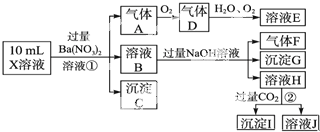
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠和铁 | B、镁和铜 |
| C、铝和镁 | D、锌和铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阿司匹林具有解热镇痛作用 |
| B、可以用Si3N4、Al2O3制作高温结构陶瓷制品 |
| C、红宝石、珍珠、玛瑙、水晶、钻石等装饰品的主要成分都是硅酸盐 |
| D、石油裂解、煤的气化、海水制镁、纤维素制火棉等过程中都包含化学变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com