
 2NaOH+H2↑+Cl2↑,阳极电子守恒计算得到;
2NaOH+H2↑+Cl2↑,阳极电子守恒计算得到; 2NaOH+H2↑+Cl2↑,反应中转移电子2mol,生成氢氧化钠为2mol,氢气0.5mol,氯气0.5mol,通入0.200mol电子后生成氢氧化钠为0.2mol,氢气0.1mol,氯气0.1mol,所以电解后溶液中NaOH的质量分数的理论值=
2NaOH+H2↑+Cl2↑,反应中转移电子2mol,生成氢氧化钠为2mol,氢气0.5mol,氯气0.5mol,通入0.200mol电子后生成氢氧化钠为0.2mol,氢气0.1mol,氯气0.1mol,所以电解后溶液中NaOH的质量分数的理论值=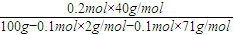 ×100%=8.63%
×100%=8.63%

科目:高中化学 来源: 题型:阅读理解
 镁将成为21世纪重要的轻型环保材料.
镁将成为21世纪重要的轻型环保材料.| 熟石灰 |
| 过滤 |
| 盐酸 |
| 蒸发、浓缩、结晶 |
| 脱水 |
| 通电 |
| 所加氢氧化钠溶液的次数 | 第一次 | 第二次 | 第三次 |
| 剩余固体的质量/g | 10.6 | 5.2 | 4.0 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
⑴ 海水中含有大量的氯化钠。请写出氯离子结构示意图 。
⑵ 目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是 (填物理变化、化学变化)。
⑶ 工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。电解饱和食盐水的化学方程式为 ;电解时与电源正极相连的电极上产生的气体是 ,常用 检验该气体。
⑷洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,写出化学反应方程式并用双线桥标出电子转移情况 。
②漂白粉的有效成分是(填化学式) 。
⑸某NaCl溶液物质的量浓度为a mol·L-1 ,对应溶液中溶质的质量分数为ω1 ;若物质的量浓度为b mol·L-1 ,则对应溶液中溶质的质量分数为ω2 ;假如b== 2 a,则 ω2 2ω1 (填:大于、小于、等于)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省瑞安中学高一上学期期中考试化学试卷 题型:填空题
(12分)海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
⑴海水中含有大量的氯化钠。请写出氯离子结构示意图 。
⑵目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是 (填物理变化、化学变化)。
⑶工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。电解饱和食盐水的化学方程式为 ;电解时与电源正极相连的电极上产生的气体是 ,常用 检验该气体。
⑷洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,写出化学反应方程式并用双线桥标出电子转移情况 。
②漂白粉的有效成分是(填化学式) 。
⑸某NaCl溶液物质的量浓度为a mol·L-1,对应溶液中溶质的质量分数为ω1;若物质的量浓度为b mol·L-1,则对应溶液中溶质的质量分数为ω2;假如b="=" 2 a,则ω2 2ω1 (填:大于、小于、等于)
查看答案和解析>>
科目:高中化学 来源:2014届浙江省高一上学期期中考试化学试卷 题型:填空题
(12分)海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
⑴ 海水中含有大量的氯化钠。请写出氯离子结构示意图 。
⑵ 目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是 (填物理变化、化学变化)。
⑶ 工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。电解饱和食盐水的化学方程式为 ;电解时与电源正极相连的电极上产生的气体是 ,常用 检验该气体。
⑷洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,写出化学反应方程式并用双线桥标出电子转移情况 。
②漂白粉的有效成分是(填化学式) 。
⑸某NaCl溶液物质的量浓度为a mol·L-1 ,对应溶液中溶质的质量分数为ω1 ;若物质的量浓度为b mol·L-1 ,则对应溶液中溶质的质量分数为ω2 ;假如b== 2 a,则 ω2 2ω1 (填:大于、小于、等于)
查看答案和解析>>
科目:高中化学 来源: 题型:
(2)若电解后溶液不小心混入KCl杂质,为了除去杂质又进行电解,当有5.6 L(标准状况)Cl2析出,可认为电解作用是完全的。求最后所得溶液中KOH的质量分数为多少。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com