
| A. | 原电池放电时,负极上发生反应的物质是Zn | |
| B. | 负极上发生的反应是Zn+2OH--2e-═Zn(OH)2 | |
| C. | 工作时,负极区溶液pH减小,正极区pH增大 | |
| D. | 溶液中OH-向正极移动,K+、H+向负极移动 |
分析 根据电池反应式知,Zn失电子发生氧化反应而作负极,氧化银作正极,负极发生反应Zn+2OH--2e-=ZnO+H2O,溶液pH值减小,正极上发生反应:Ag2O+H2O+2e-═2Ag+2OH-,溶液pH增大,放电时,电解质溶液中阴离子向负极移动、阳离子向正极移动,据此分析解答.
解答 解:A.根据电池反应式知,放电时Zn元素化合价由0价变为+2价,所以负极上Zn失电子发生氧化反应,故A正确;
B.负极上锌失电子发生氧化反应,电极反应式为Zn+2OH--2e-═Zn(OH)2,故B正确;
C.负极发生反应Zn+2OH--2e-=ZnO+H2O,氢氧根离子参加反应导致氢氧根离子浓度降低,则负极区域pH减小;正极反应式为Ag2O+H2O+2e-═2Ag+2OH-,溶液pH增大,故C正确;
D.放电时,电解质溶液中OH-向负极移动,K+、H+向正极移动,故D错误;
故选D.
点评 本题考查化学电源新型电池,为高频考点,明确各个电极上发生的反应是解本题关键,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,易错选项是D,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
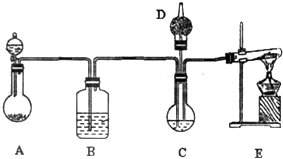 纳米碳酸钙有广泛的应用前景.用下图所示装置,在浓CaCl2溶液中通入NH3和CO2可制得纳米级碳酸钙.D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.
纳米碳酸钙有广泛的应用前景.用下图所示装置,在浓CaCl2溶液中通入NH3和CO2可制得纳米级碳酸钙.D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-l | B. | 0.2 mol•L-l | C. | 0.3 mol•L-l | D. | 0.4 mol•L-l |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积比 1:1 | B. | 体积比 11:16 | ||
| C. | 物质的量比 16:11 | D. | 密度比 11:16 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com