
| A.在氯化钠晶体中,每个Na+周围有6个Cl-,形成离子晶体 |
| B.在氯化钠晶体中存在NaCl分子 |
| C.石英是由SiO2形成的分子晶体 |
| D.金刚石和石墨晶体都是由碳原子形成的网状结构,是典型的原子晶体 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
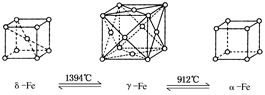
| A.将铁加热到1500°C分别急速冷却和缓慢冷却,得到的晶体类型相同 |
| B.α-Fe晶体中与每个铁原子等距离且最近的铁原子有6个 |
| C.若δ-Fe晶胞边长为a cm,α-Fe晶胞边长为b cm,则两种晶体密度比为2b3:a3 |
| D.δ-Fe晶体中与每个铁原子等距离且最近的铁原子有8个 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.石英和生石灰的熔化 | B.冰的熔化和氯化钠的熔化 |
| C.晶体硅和晶体硫的熔化 | D.钠和铁的熔化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
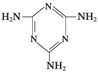 俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸
俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸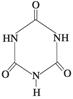 后,
后,
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.晶格能是气态离子形成1摩离子晶体释放的能量 |
| B.晶格能通常取正值,但是有时也取负值 |
| C.晶格能越大,形成的离子晶体越不稳定 |
| D.晶格能越大,物质的硬度反而越小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

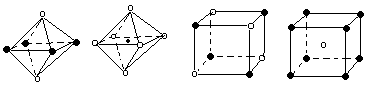
| A.① | B.② | C.③ | D.④ |
| 分子或离子 | H2S | SnCl62- | PH3 | ClO4-- |
| 空间构型 | | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在NaCl晶体中,距Na+最近的Cl-形成正八面体 |
| B.在NaCl晶体中,每个晶胞平均占有4个Na+ |
| C.在CsCl晶体中,每个晶胞平均占有8个Cs+ |
| D.铜晶体为面心立方堆积,铜原子的配位数(距离一个铜原子最近的其它铜原子的个数)为12 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.585/4a3ρ | B.58.5/8a3ρ | C.58.5/2a3ρ | D.117/a3ρ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
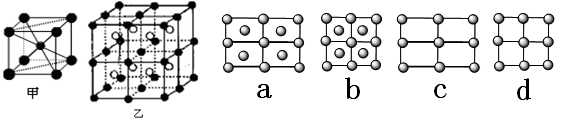
 原子周围距离最近的
原子周围距离最近的 原子有 个。
原子有 个。
 表示C原子,
表示C原子, 表示镁原子
表示镁原子 =1.414)CXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为4.28×10-10m。晶胞中两个C原子之间的最短距离为___________m(精确至0.01)。若晶体中的C分别为C2﹢、C3﹢,此晶体中C2﹢与C3﹢的最简整数比为_________。
=1.414)CXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为4.28×10-10m。晶胞中两个C原子之间的最短距离为___________m(精确至0.01)。若晶体中的C分别为C2﹢、C3﹢,此晶体中C2﹢与C3﹢的最简整数比为_________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com