
| A. | 电解饱和食盐水的离子方程式:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 向淀粉KI溶液中滴加稀硫酸溶液变蓝:4I-+O2+4H+=2H2O+2I2 | |
| C. | 加入铝粉能产生氢气的溶液中可能存在大量的K+、Ba2+、AlO2-、Cl- | |
| D. | HCO3-水解的离子方程式:HCO3-+H2O=CO32-+H3O+ |
分析 A.电解生成NaOH、氢气、氯气;
B.发生氧化还原反应生成碘、水;
C.加入铝粉能产生氢气的溶液,为非氧化性酸或强碱溶液;
D.水解生成碳酸和氢氧根离子.
解答 解:A.电解饱和食盐水的离子方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,故A正确;
B.向淀粉KI溶液中滴加稀硫酸溶液变蓝的离子反应为4I-+O2+4H+=2H2O+2I2,故B正确;
C.加入铝粉能产生氢气的溶液,为非氧化性酸或强碱溶液,碱性溶液中该组离子之间不反应,可大量共存,故C正确;
D.HCO3-水解的离子方程式为HCO3-+H2O?H2CO3+OH-,故D错误;
故选D.
点评 本题考查了离子方程式的正误判断,为高频考点,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和、电子、电荷守恒等)等,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1mol H2O的质量为18g•mol-1 | |
| B. | CO2的摩尔质量为44g | |
| C. | 1mol任何物质的质量等于该物质的相对分子质量 | |
| D. | H+的摩尔质量为1g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
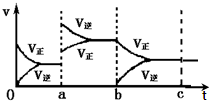 如图表示在密闭容器中反应:2SO2+O2?2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是升温;bc过程与ab过程相比化学平衡常数不变.(填“增大”“减小”或“不变”)
如图表示在密闭容器中反应:2SO2+O2?2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是升温;bc过程与ab过程相比化学平衡常数不变.(填“增大”“减小”或“不变”)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ω=$\frac{35a}{22.4Vρ}$×100% | |
| B. | c=$\frac{1000a}{22.4Vρ}$×100%mol/L | |
| C. | 上述溶液中再加入1.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| D. | 上述氨水中再加入V mL水后,所得溶液的质量分数大于0.5ω |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素X、Y、Z、M、N为短周期主族元素,且原子序数依次增大,已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4且M原子的质子数是Y原子的2倍,N-、Z+、X+的半径逐渐减小,化合物XN在常温下为气体,据此回答下列问题:
元素X、Y、Z、M、N为短周期主族元素,且原子序数依次增大,已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4且M原子的质子数是Y原子的2倍,N-、Z+、X+的半径逐渐减小,化合物XN在常温下为气体,据此回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若t1=15 s,则用A的浓度变化表示的t0~t1段的平均反应速率为0.004mol•L-1•s-1 | |
| B. | t4~t5阶段改变的条件一定为增大压强 | |
| C. | 该容器的容积为2 L,B的起始物质的量为0.02 mol | |
| D. | t5~t6阶段,容器内A的物质的量减少了0.06 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式为:3A(g)?B(g)+2C(g)△H=+50a kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com