
| A.一定条件下,2molsO2与足量O2反应可得到2molsO3 |
| B.含4mol HCl的浓盐酸与足量的MnO2加热反应可制备1mol Cl2 |
| C.10mL 18.0mol/L H2SO4与足量铜加热反应可制备0.09molsO2 |
| D.一定条件下,1mol N2与3mol H2反应可制备1.0mol NH3 |
 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源:不详 题型:单选题
 xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是 ( )
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是 ( )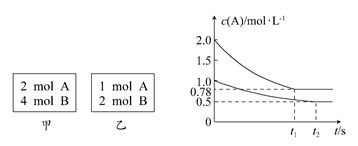
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3,正反应速率分别用v(SO2)、v(O2)、v(SO3)(mol·L-1·min-1)表示,逆反应速率分别用v′(SO2)、v′(O2)、v′(SO3)(mol·L-1·min-1)表示,当反应达到化学平衡时,正确的关系是
2SO3,正反应速率分别用v(SO2)、v(O2)、v(SO3)(mol·L-1·min-1)表示,逆反应速率分别用v′(SO2)、v′(O2)、v′(SO3)(mol·L-1·min-1)表示,当反应达到化学平衡时,正确的关系是 v′(SO2)
v′(SO2)| A.①②③④ | B.①②③ | C.②③④ | D.①③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.当有1 mol N≡N键断裂的同时,有3 mol H—H键断裂 |
| B.当有1 mol N≡N键断裂的同时,有6 mol N—H键形成 |
| C.当有1 mol N≡N键断裂的同时,有6 mol H—H键形成 |
| D.当有1 mol N≡N键断裂的同时,有6 mol N—H键断裂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 NH2COONH4(s)
NH2COONH4(s)| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
 NH2COONH4(s)的化学平衡常数K= 。
NH2COONH4(s)的化学平衡常数K= 。 NH4HCO3+NH3·H2O。该学习小组为亲身体验其水解反应,分别取两份制得的样品,将其溶于水中并配制成不同浓度的氨基甲酸铵溶液,绘制出c(NH2COO—)随时间(t)变化的曲线如图所示,若A、B分别为不同温度时测定的曲线,则 (填“A”或“B”)曲线所对应的实验温度高,判断的依据是 。
NH4HCO3+NH3·H2O。该学习小组为亲身体验其水解反应,分别取两份制得的样品,将其溶于水中并配制成不同浓度的氨基甲酸铵溶液,绘制出c(NH2COO—)随时间(t)变化的曲线如图所示,若A、B分别为不同温度时测定的曲线,则 (填“A”或“B”)曲线所对应的实验温度高,判断的依据是 。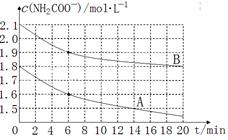
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 TaI4(g)+S2(g) ΔH>0(I)
TaI4(g)+S2(g) ΔH>0(I)
 HSO3-+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中 将________(填“增大”“减小”或“不变”)。
将________(填“增大”“减小”或“不变”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
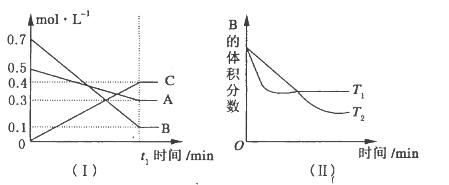
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:| 压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1 000 | e | f | 83.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
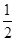 O2(g)
O2(g) CO(g)+2H2(g) ΔH<0
CO(g)+2H2(g) ΔH<0 CO(g)+3H2(g) ΔH>0
CO(g)+3H2(g) ΔH>0| A.当反应①中v(CH4)正=v(CO)逆时,表明该反应达平衡状态 |
| B.其他条件不变时,增大体系压强,反应①、②中甲烷的转化率均减小 |
| C.使用高效催化剂可以加快反应速率,同时提高CH4的转化率 |
| D.同一容器内同时发生反应①与②时,容器内温度可能保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com