
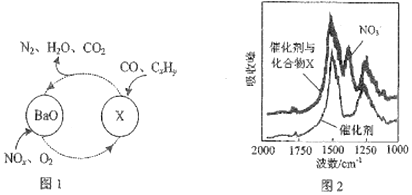
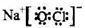 .
.分析 (1)①根据化合价降低为氧化剂被还原判断;根据傅里叶红外光谱图(如图2所示)确定化合物X含硝酸根;
②根据氮元素原子的核外电子排布情况确定在周期表的位置;
(2)根据NOx与NH3的直接反应,实现无害转化,则生成氮气和水,据此书写方程式;促使化学平衡正向移动的因素就可以提高氮氧化物的转化率;
(3)二氧化氮具有氧化性,亚硫酸钠具有还原性,根据氧化还原反应的规律知识来回答判断;
(4)①根据次氯酸钠氧化废水中NH4+ 完全转化为N2,而本身被还原为NaCl结合得失电子守恒配平方程式,根据反应的离子方程式进行计算;
②检验铵根离子,通常加入强碱溶液加热,然后用湿润的红色石蕊试纸检验,若试纸变蓝,则证明溶液中含有铵根离子,据此进行解答;
③根据反应的离子方程式进行计算.
解答 解:(1)①在图1所示的转化中N、O化合价降低为氧化剂被还原;由傅里叶红外光谱图(如图2所示)确定化合物X含硝酸根,再结合图一由钡离子参与,所以X为Ba(NO3)2;
故答案为:N、O;Ba(NO3)2;
②氮元素原子的核外电子排布是2、5,所以氮元素在周期表中的位置是:第二周期ⅤA族,故答案为:第二周期ⅤA族;
(2)因为NOx与NH3的直接反应,实现无害转化,则生成氮气和水,所以当NO与NO2的物质的量之比为2:1时,发生反应的化学方程式为16NH3+12NO+6NO2=17N2+24H2O,促使化学平衡正向移动的因素就可以提高氮氧化物的转化率,反应△H<O,为提高氮氧化物的转化率可采取的措施是:降温,
故答案为:16NH3+12NO+6NO2=17N2+24H2O;降温;
(3)二氧化氮具有氧化性,亚硫酸钠具有还原性,二者之间会发生氧化还原反应:2NO2+4SO32-=N2+4SO42-,故答案为:2NO2+4SO32-=N2+4SO42-;
(4)①次氯酸钠为离子化合物,电子式应为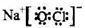 ,故答案为:
,故答案为: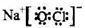 ;
;
②检验铵根离子的方法为:向待测液里加入NaOH溶液,加热,将湿润的红色石蕊试纸放在液面上方,如果溶液变蓝,则待测液中肯定含有NH4+,
故答案为:向溶液里滴加浓NaOH溶液并加热,如果有气体放出且能使湿润的红色石蕊试纸变蓝,则溶液里含有NH4+.
③因为次氯酸钠氧化废水中NH4+ 完全转化为N2,而本身被还原为NaCl,根据得失电子守恒,离子方程式为2NH4++3ClO-=N2↑+3Cl-+2H++3H2O,
由2NH4++3ClO-=N2↑+3Cl-+2H++3H2O得,处理废水产生了0.448L即0.02mol N2(标准状况),则需消耗浓度为2mol•L-1的次氯酸钠的体积为$\frac{0.02×3}{2}$×1000ml=30ml,故答案为:30.
点评 本题重点考查了氧化还原反应以及电解池的原理,从深层次的理解氧化还原反应的本质是解决本题的关键,难度不大,注意化合价降低为氧化剂被还原,化合价升高为还原剂被氧化.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由元素X与Z形成的化合物中只含共价键 | |
| B. | XY2、ZY2、M2Y2的晶体分别属于3种不同类型的晶体 | |
| C. | 单质M的晶体是体心立方堆积,M的配位数是8 | |
| D. | X的氢化物X2H2分子中含有2个σ键和3个π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
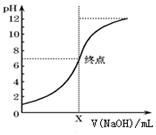 某学生用0.10mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂.重复上述滴定操作2~3 次,记录数据如下.
某学生用0.10mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂.重复上述滴定操作2~3 次,记录数据如下.| 数 | 待测液体积 (mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 23.40 |
| 第二次 | 25.00 | 4.00 | 23.90 |
| 第三次 | 25.00 | 5.00 | 25.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
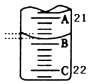 定量分析是化学实验中重要的组成部分.
定量分析是化学实验中重要的组成部分.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 26.32 | 24.02 | 23.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 c1<c2 | B. | c1>c2 | C. | c1=c2 | D. | 2 c1=c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Q2=Q1=92.4 | B. | Q2<Q1<92.4 | C. | Q1=Q2=92.4 | D. | Q1<Q2<92.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com