
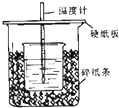
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 用醋酸除水垢:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 氯乙酸与氢氧化钠溶液共热:CH2ClCOOH+OH-$\stackrel{△}{→}$CH2ClCOO-+H2O | |
| C. | 用新制氢氧化铜悬浊液检验乙醛中的醛基:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O | |
| D. | 苯酚钠溶液中通入少量二氧化硫:C6H5O-+SO2+H2O→C6H5OH+HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| B. | 0.5 mol苯分子中含有C=C双键数为1.5 NA | |
| C. | 1 mol甲基(-CH3)所含的电子总数为10 NA | |
| D. | 标准状况下,1L甲醇完全燃烧后生成的CO2分子数目约为$\frac{{N}_{A}}{22.4}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离 子 | 要 求 |
| A | NH4+、Al3+、SO42-、H+ | 滴加NaOH溶液立刻有气体产生 |
| B | K+、NO3-、Cl-、HS- | c(K+)<c(Cl-) |
| C | Fe2+、NO3-、SO42-、Cl- | 逐滴滴加盐酸时溶液没有颜色变化 |
| D | Na+、HCO3-、Mg2+、SO42- | 滴加氨水立即有沉淀产生 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质和葡萄糖在一定条件下完全燃烧都只生成CO2和水 | |
| B. | 75%(体积分数)的乙醇溶液常用于医疗消毒 | |
| C. | 石油的分馏和煤的干馏均属于物理变化 | |
| D. | 乙烯和苯都能使溴水褪色,褪色的原因相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
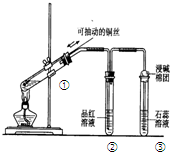
| A. | 上下移动①中铜丝可控制SO2的量 | |
| B. | ②中品红溶液不褪色 | |
| C. | ③中石蕊溶液变蓝色 | |
| D. | 为确认CuSO4生成,向①中加水,观察溶液颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(K+) | |
| B. | Va=Vb时:c(CH3COOH)+c(H+)>c(OH-) | |
| C. | Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+) | |
| D. | Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com