
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O===2NO+HNO3+9HF,下列有关该反应的说法正确的是
A.NF3是氧化剂,H2O是还原剂
B.还原剂和氧化剂的物质的量之比是2∶1
C.若生成0.2 mol HNO3,则转移0.2 mol电子
D.NF3在潮湿的空气中泄漏会产生红棕色气体
 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
下图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置。
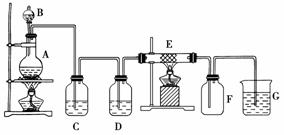
试回答:
(1)C、D、G三个装置所盛放的试剂分别是:
C_____________________________________________________
D___________
G
(2)F中的现象为___________________________,生成物是________。
(3)写出在A、E、G中发生反应的化学方程式为:
A: ;
E: ;
G
查看答案和解析>>
科目:高中化学 来源: 题型:
检验SO2中是否混有CO2气体,可采用的方法是( )。
A.通过品红溶液 B.先通过NaOH溶液,再通入澄清石灰水
C.通过澄清石灰水 D.先通过KMnO4酸性溶液,再通过澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
空气质量越来越受到人们的关注,下表是我国部分城市空气质量周报:
| 城市 | 污染指数 | 首要污染物 | 空气质量等级 |
| 太原 | 98 | SO2 | Ⅱ |
| 青岛 | 47 | Ⅰ | |
| 兰州 | 103 | TSP | Ⅲ |
| 广州 | 90 | NOx | Ⅱ |
(注:TSP——总悬浮颗粒物;NOx——氮氧化物)
(1)由上表可知,从理论上分析最容易出现酸雨的城市是________。
(2)悬浮颗粒物不易沉降,它与空气中的SO2、O2接触时,SO2会部分转化为SO3,悬浮颗粒物所起的作用是________(填序号)。
A.氧化剂 B.还原剂 C.催化剂 D.吸附剂
(3)氮的氧化物也是大气污染物之一。目前,治理NO的方法是在一定条件下用氨把一氧化氮还原为氮气和水。科学家又设想,在相同条件下可采用价格比NH3更便宜的天然气来处理NO,达到同样效果,写出该反应的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.合成氨工业中,移走NH3可增大正反应速率,提高原料转化率
B.酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液
C.将NO2、N2O4混合气体的体积压缩为原来的一半,则气体颜色加深
D.牺牲阳极的阴极保护法和外加直流电源的阴极保护法都是应用电解原理
查看答案和解析>>
科目:高中化学 来源: 题型:
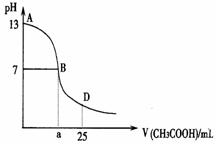 下图为向25mL 0.1 mol·L-1 NaOH溶液中逐滴滴加0.2 mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线。请回答:
下图为向25mL 0.1 mol·L-1 NaOH溶液中逐滴滴加0.2 mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线。请回答:
(1)B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确? (选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内? 区间(若正确,此问不答)
(2)AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)大于、小于或等于c(CH3COO-)
(3)在D点时,溶液中c(CH3COO-)+c(CH3COOH) 2c(Na+)( “>”、“<”或“=”)
(4)常温下,将VmL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中,充分反应。回答下列问题。(忽略溶液体积的变化)
①如果溶液pH=7,此时V的取值__ ___20.00(填“>”、“<”或“=”),而溶液中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为__________________________________。
②如果V=40.00,则此时溶液中c(OH-) -c(H+) - c(CH3COOH)= _________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③碘水溶液。分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
为达到预期的实验目的,下列操作正确的是( )
A.欲配制量分数为10%的ZnSO4溶液,将10gZnSO4 7H2O溶解在90g水中
7H2O溶解在90g水中
B.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeC13饱和溶液并长时间煮沸
C.可以使用乙醇提取溴水中的溴单质
D.为鉴别KC1、A1C13和MgC12溶液,各取少量三种溶液分别滴加NaOH溶液至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.钠保存在煤油里的原因之一是它极易与氧气反应
B.铝在空气中很容易燃烧
C.镁表面的氧化膜疏松,不能保护内层金属
D.铁锈的主要成分是Fe3O4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com