
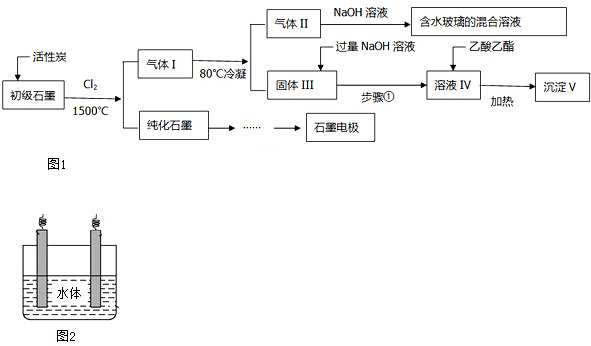
| △ |
5.1kg×
| ||
|
| △ |
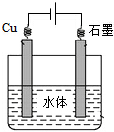 ,
, .
.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+ |
| B、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
| C、少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O═C6H5OH+HSO3- |
| D、FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某有机物的结构简式如图,下列叙述正确的是( )
某有机物的结构简式如图,下列叙述正确的是( )| A、该有机物的分子式为C14H20O4 |
| B、该有机物能发生取代、加成和聚合反应 |
| C、1mol该有机物最多能与3mol NaOH反应 |
| D、该有机物分子中所有碳原子一定共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将少量SO2气体通入NaClO溶液中SO2+2ClO-+H2O═SO32-+2HClO |
| B、苯酚钠溶液中通入少量的二氧化碳气体C6H5O-+CO2+H2O═C6H5OH+HCO3- |
| C、足量的溴化亚铁溶液和少量的氯气反应2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| D、向氯化铝溶液中加入过量的氨水Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.
钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.| [NH3?H2O] | ||
[N
|
| 5.56 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH皆等于3 的两种溶液都稀释100倍后,pH都为5 |
| B、10mL 0.02mol/L HCl溶液与10mL 0.02mol/L Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7 |
| C、在0.1mol/L某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A) |
| D、室温下,在一定量稀氨水中逐滴滴入稀盐酸,对于所得溶液中离子浓度大小关系可能是:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性:H3AsO4>H2SO4>H3PO4 |
| B、微粒的半径:Cl->Na+>Mg2+>Al3+ |
| C、热稳定性:HF>HCl>HBr>HI |
| D、熔点:SiO2>NaCl>I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com