
| t/s c/(mol•L-1) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol•L-1) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2)/(mol•L-1) | 0 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
分析 (1)由表可知,60s时反应达平衡,根据方程式计算△c(N2O4),根据转化率计算平衡时N2O4的转化率;
根据方程式计算,计算c2、c3,据此解答;
60s后反应达平衡,反应混合物各组分的浓度不变.
(2)由△c(NO2),根据方程式计算△c(N2O4),20s的四氧化二氮的浓度=起始浓度-△c(N2O4);
根据v=$\frac{△c}{△t}$计算v(N2O4).
(3)80℃时,达到平衡时NO2的物质的量为0.100mol,说明降低温度后平衡向着逆向移动,据此判断反应热;
(4)达到上述同样的平衡状态,说明两个平衡为等效平衡,按化学计量数换算到N2O4一边,满足c(N2O4)为0.100mol/L.
解答 解:(1)由表可知,60s时反应达平衡,c(NO2)=0.120mol/L,根据反应N2O4?2NO2可知,平衡时消耗二氧化氮的浓度为:c(N2O4)=0.120mol/L×$\frac{1}{2}$=0.06mol/L,则平衡时N2O4的转化率为:$\frac{0.06mol/L}{0.1mol/L}$×100%=60%;
达到平衡时各组分的浓度不再变化,则c3=a=b=0.1mol/L-0.06mol/L=0.04mol/L;
由表可知,40s时,c(N2O4)=0.050mol/L,N2O4的浓度变化为:(0.1-0.05)mol/L=0.05mol/L,则c2=0.05mol/L×2=0.10mol/L,所以c2>c3,
故答案为:60;>;=;
(2)由表可知,20s时,c(NO2)=0.060mol/L,则反应消耗 N2O4的浓度为0.030mol/L,则20s的四氧化二氮的浓度c1=0.1mol/L-0.03mol/L=0.07mol/L;
在0s~20s内四氧化二氮的平均反应速率为v(N2O4)=$\frac{0.03mol/L}{20s}$=0.0015mol•(L•s)-1,
故答案为:0.07mol/L;0.0015;
(3)若其他反应条件以及初始物质物质的量不变,将反应的温度降低到80℃时,达到平衡时NO2的物质的量为0.100mol<0.120mol/L,说明降低温度后平衡向着放热的逆向移动,则逆向为放热反应,故正反应为吸热反应,
故答案为:吸热;
(4)达到上述同样的平衡状态,为等效平衡,按化学计量数换算到N2O4一边,满足c(N2O4)为0.100mol/L即可,根据反应N2O4 ?2 NO2可知二氧化氮的浓度应该为:c(NO2)=2c(N2O4)=0.1mol/L×2=0.20mol/L,
故答案为:0.20mol/L.
点评 本题考查化学平衡的有关计算,题目难度中等,涉及化学反应速率、转化率等的计算、等效平衡的应用等知识,注意掌握化学反应速率、转化率的概念及表达式,明确等效平衡的判断方法为解答关键,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
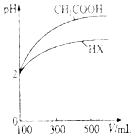 水是生命的源泉,工业的血液、城市的命脉,要保护好河流,河水是重要的饮用水源,污染物通过用水直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请问答下列问题:
水是生命的源泉,工业的血液、城市的命脉,要保护好河流,河水是重要的饮用水源,污染物通过用水直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请问答下列问题:| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3x10-7,K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
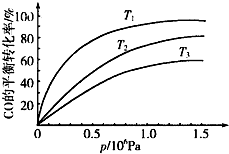 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:| 温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,平衡常数K变大 | |
| B. | 增大压强,W(g)物质的量分数变大 | |
| C. | 升温,若混合气体的平均相对分子质量变小,则正反应放热 | |
| D. | 增大X浓度,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新的平衡体系中,N2的浓度小于2c mol/L大于c mol/L | |
| B. | 新的平衡体系中,NH3的浓度小于2c mol/L大于c mol/L | |
| C. | 新的平衡体系中,混合气体的平均摩尔质量小于$\overline{M}$ | |
| D. | 新的平衡体系中,气体的密度是原平衡体系的1倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色.
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com