
 SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3


 SO3(g)+NO(g)
SO3(g)+NO(g)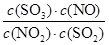 =
=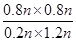 =
=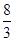
 CH3OH(g)+H2O(g)可知,消耗CO2和氢气的浓度分别是0.75mol/L和2.25mol/L,生成水蒸气的浓度是0.75mol/L。则平衡时CO2和氢气的浓度分别是1mol/L-0.75mol/L=0.25mol/L、3mol/L-2.25mol/L=0.75mol,所以该反应的平衡常数K=
CH3OH(g)+H2O(g)可知,消耗CO2和氢气的浓度分别是0.75mol/L和2.25mol/L,生成水蒸气的浓度是0.75mol/L。则平衡时CO2和氢气的浓度分别是1mol/L-0.75mol/L=0.25mol/L、3mol/L-2.25mol/L=0.75mol,所以该反应的平衡常数K=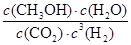 =
=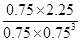 =
=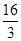 。若在上述平衡体系中再充0.5molCO2和1.5mol水蒸气(保持温度不变),则此时浓度商为
。若在上述平衡体系中再充0.5molCO2和1.5mol水蒸气(保持温度不变),则此时浓度商为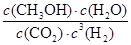 =
=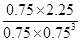 =
=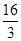 ,所以此平衡将不移动。
,所以此平衡将不移动。

 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源:不详 题型:填空题

 CH3OH(g)
CH3OH(g)
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 化学键 | H—H | N—H | N≡N |
| 键能kJ·mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) △H= -90.8kJ/mol
CH3OH(g) △H= -90.8kJ/mol CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol CO2(g)+H2(g) △H=-41.3kJ/mol
CO2(g)+H2(g) △H=-41.3kJ/mol CH3OCH3(g)+CO2(g) 的△H= ;
CH3OCH3(g)+CO2(g) 的△H= ; CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol·L-1) | 0.40 | 0.6 | 0.6 |
 _________
_________ (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


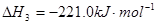
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 SO3(g) K1,CO(g)+1/2O2(g)
SO3(g) K1,CO(g)+1/2O2(g)  CO2(g) K2。则相同温度下反应SO2(g)+CO2(g)
CO2(g) K2。则相同温度下反应SO2(g)+CO2(g)  SO3(g)+CO(g)的平衡常数为 。
SO3(g)+CO(g)的平衡常数为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
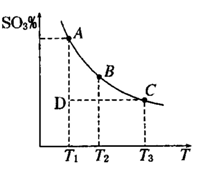
 2SO3(g),混合体系中SO3 的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题,
2SO3(g),混合体系中SO3 的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题, 2SO3(g)的△H 0
2SO3(g)的△H 0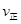
 (填“>”“<”或“=”)
(填“>”“<”或“=”)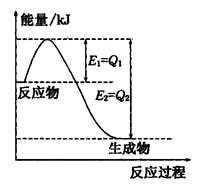
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题

 CH3OH(g) △H=QkJ/mol
CH3OH(g) △H=QkJ/mol ( CH3OH)与反应温度T的关系曲线如图2所示,则上述反应的Q_____0(填“>”“<”或“=”);
( CH3OH)与反应温度T的关系曲线如图2所示,则上述反应的Q_____0(填“>”“<”或“=”);查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com