
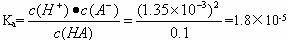
��1��ǡ����ȫ�к�ʱ��B�㣩��Һ��pH_______7(�������������=��)��������______________��
��2�����������AB��ˮ��Һ��ﵽƽ��ʱ��AB![]() A++B-������K����=
A++B-������K����=![]()
ʽ��c��A+����c��B-����c��AB���ֱ��ʾ����A+��B-��AB����ƽ��ʱ�����ʵ���Ũ�ȣ�K������������ʵĵ���ƽ�ⳣ������Ƶ��볣����һ���¶��£����볣��������ҺŨ�ȸı���ı䣬ͨ���������ϵ��Ķ���������һԪ����ĵ��볣����
��3����A���pH����lg1.35=0.13 lg1.8=0.26��
��1���� ��ǡ����ȫ�к�ʱ���ɵ�����ǿ�������Σ�������ˮ��ʹ��Һ�ʼ���
��2��Ka=1.8��10-5
��3��pH=4.7
������(2)��ͼ�п��Կ�����0.1 mol��L-1һԪ������Һ��pH=2.87,��c(H+)=10-2.87=1.35��10-3 mol��L-1����HA![]() H++A-����c��A-��=c��H+��=1.35��10 -3 mol��L-1��c��HA��=0.1-c��H+����0.1 mol��L-1������һԪ����ĵ��볣��Ϊ
H++A-����c��A-��=c��H+��=1.35��10 -3 mol��L-1��c��HA��=0.1-c��H+����0.1 mol��L-1������һԪ����ĵ��볣��Ϊ
![]()
(3)A��ʱ�����ᱻ�к�һ�룬��ʱ��Һ��c(A-)��c(HA)����![]() ��c��H+��=1.8��10-5 mol��L-1��pH=4.7��
��c��H+��=1.8��10-5 mol��L-1��pH=4.7��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 pD��g��+qE��s������H��0��m��n��p��qΪ��������ȣ���
pD��g��+qE��s������H��0��m��n��p��qΪ��������ȣ���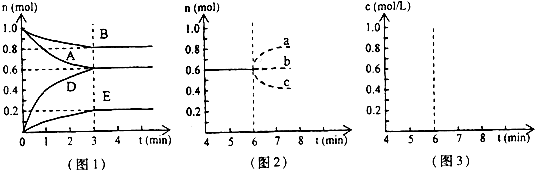


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 H2CO3+OH-
H2CO3+OH- H2CO3+OH-
H2CO3+OH- 2SO3��H��0����ͼ��ʾ�÷�Ӧ�����ʣ�v����ʱ�䣨t���仯�Ĺ�ϵ��t2��t3��t5ʱ��������������ı䣬����û�иı�����ʵij�ʼ������������˵������ȷ����
2SO3��H��0����ͼ��ʾ�÷�Ӧ�����ʣ�v����ʱ�䣨t���仯�Ĺ�ϵ��t2��t3��t5ʱ��������������ı䣬����û�иı�����ʵij�ʼ������������˵������ȷ���� 2SO3�ﵽƽ���SO3���������Ϊ a%��SO2��ת����Ϊm��
2SO3�ﵽƽ���SO3���������Ϊ a%��SO2��ת����Ϊm�� �鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��ѧ����Դ��������������ʮ�ֹؼ������ã�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�
��ѧ����Դ��������������ʮ�ֹؼ������ã�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�| 1 |
| 2 |
| 1 |
| 2 |
| ���ʵ���/��mol��/ʱ�䣨h�� | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| X | |||
| Y | Z |
�鿴�𰸺ͽ���>>
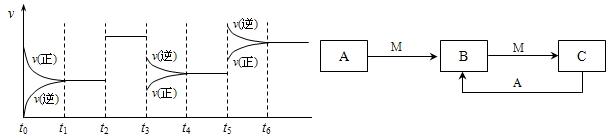
��Ŀ�����л�ѧ ��Դ��2015�콭������һ�и߶���ѧ�����п��Ի�ѧ�Ծ���ѡ�ޣ��������棩 ���ͣ�ѡ����
��֪ij���淴Ӧ��mA(g)+nB(g)
 pC(g)
��H=Q
kJ��mol-1 �����ܱ������н��У���ͼ��ʾ�ڲ�ͬʱ��t���¶�T��ѹǿP�뷴Ӧ��B�İٷֺ����Ĺ�ϵ���ߣ������ж���ȷ����
pC(g)
��H=Q
kJ��mol-1 �����ܱ������н��У���ͼ��ʾ�ڲ�ͬʱ��t���¶�T��ѹǿP�뷴Ӧ��B�İٷֺ����Ĺ�ϵ���ߣ������ж���ȷ����
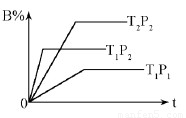
A��T2 ��T1 P1 �� P2 m+n �� p �� ����0
B��T1 ��T2 P1 �� P2 m+n �� p �� ����0
C��T1 ��T2 P1 �� P2 m+n �� p �� ����0
D��T1 ��T2 P1 �� P2 m+n �� p �� ����0
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com