
【题目】已知2A2(g)+B2(g) ![]() 2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的固定容积的容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的固定容积的容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达到平衡时, A2的转化率为________。
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将_____(填“增大“、“减小”或“不变”)
(3)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量Q3 kJ,C3浓度 (填>、=、<)w mol·L-1,Q1、Q2、Q3 之间满足何种关系
(4)能说明该反应已经达到平衡状态的是 。
a.v(C3)=2 v (B2);
b.容器内压强保持不变
c.2v逆(A2)=v正(B2)
d.容器内的密度保持不变
(5)改变某一条件,得到如图的变化规律
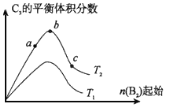
(图中T表示温度,n表示物质的量),可得出的结论正确的是 ;
a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(6)若将上述容器改为恒压容器(反应前体积相同),起始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 (填“>”、“<”或“=”)。
(7)下列措施可以同时提高反应速率和B2的转化率是(填选项序号) 。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的C3 d.升高温度
【答案】(1)Q2/Q1
(2)不变
(3)=;Q1=Q2+Q3
(4)b
(5)ad
(6)<
(7)b
【解析】
试题分析:(1)根据2A2(g)+B2(g) ![]() 2C3(g);△H=-Q1 kJ/mol(Q1>0),达平衡后放出热量为Q2 kJ,设参加反应的A2为n mol,则n:2=Q2:Q1,达到平衡时, A2的转化率为[(2Q2/Q1)÷2]x100%=Q2/Q1。
2C3(g);△H=-Q1 kJ/mol(Q1>0),达平衡后放出热量为Q2 kJ,设参加反应的A2为n mol,则n:2=Q2:Q1,达到平衡时, A2的转化率为[(2Q2/Q1)÷2]x100%=Q2/Q1。
故答案为:Q2/Q1;
(2) 因为是在恒容的密闭容器中,达到平衡后,若向原容器中通入少量的氩气,没有影响体积,所以平衡不移动,A2的转化率不变。
故答案为:不变;
(3)根据等效平衡的理论,只加入2mol C3,相当于加入2 molA2和1 molB2,所以C3浓度=w mol·L-1,Q1、Q2、Q3 之间的关系为Q1=Q2+Q3。
故答案为:=;Q1=Q2+Q3;
(4)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。a.v(C3)=2 v (B2)没有标注正逆反应,a错误;b.反应是气体压强减小的反应,平衡状态容器内压强保持不变,说明反应达到平衡,b正确;c.依据反应速率之比等于化学方程式的系数之比可知,v逆(A2)=2v正(B2),说明v逆(A2)=v正(A2),c错误;d.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,即反应过程和平衡状态容器内的密度保持不变,d错误,选b。
故答案为:b;
(5)a.增大B2的浓度,反应速率增大,a正确;b.达到平衡时A2的转化率大小为:c>b>a,b错误;c.正反应是放热反应,升高温度反应速率增大,但平衡向逆反应方向移动,c错误; d.按系数比加入各反应物,按系数比消耗各物质,所以平衡时仍为2:1,d正确。
故答案为:ad;
(6)原平衡随反应进行,压强降低.恒压容器(反应器开始体积相同),相同温度下起始加入2molA2和1molB2,等效为在原平衡的基础上增大压强,平衡向气体体积减小的方向移动,即向正反应移动,则Q2<Q4。
故答案为:<;
(7)a.催化剂只能加快化学速率,不能改变平衡状态,不符合;b.增大压强,平衡向正反应方向移动,符合;c.及时分离生成的C3,化学反应速率减慢,不符合,d.升高温度,平衡逆向移动,不符合。故答案为:b。


科目:高中化学 来源: 题型:
【题目】水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg/L,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg/L。某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO。
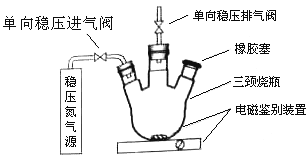
1、测定原理:
碱性体积下,O2将Mn2+氧化为MnO(OH)2:①2Mn2++O2+4OH-=2 MnO(OH)2↓,酸性条件下,MnO(OH)2将I-氧化为I2:②MnO(OH)2+I-+H+→Mn2++I2+H2O(未配平),用Na2S2O3标准溶液滴定生成的I2,③2S2O32-+I2=S4O62-+2I-
2、测定步骤
a.安装装置,检验气密性,充N2排尽空气后,停止充N2。
b.向烧瓶中加入200ml水样
c.向烧瓶中依次迅速加入1mlMnSO4无氧溶液(过量)2ml碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。
d搅拌并向烧瓶中加入2ml硫酸无氧溶液至反应②完全,溶液为中性或若酸性。
e.从烧瓶中取出40.00ml溶液,以淀粉作指示剂,用0.001000mol/L Na2S2O3溶液进行滴定,记录数据。
f.……
g.处理数据(忽略氧气从水样中的溢出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)配置以上无氧溶液时,除去所用溶剂水中氧的简单操作为__________。
(2)在橡胶塞处加入水样及有关试剂应选择的仪器为__________。
①滴定管②注射器③量筒
(3)搅拌的作用是__________。
(4)配平反应②的方程式,其化学计量数依次为__________。
(5)步骤f为__________。
(6)步骤e中达到滴定终点的标志为__________。若某次滴定消耗Na2S2O3溶液4.50ml,水样的DO=__________mg/L(保留一位小数)。作为饮用水源,此次测得DO是否达标:__________(填是或否)
(7)步骤d中加入硫酸溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因(用离子方程式表示,至少写出2个)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质的分子式为CxHyOz,取该物质ag在足量的O2中充分燃烧后,将产物全部通入过量的Na2O2中,若Na2O2固体的质量增加了bg,并且a<b,则x、y、z必须满足的关系是
A.x>z B.x=y=z C.x=z D.x<z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应
B.油脂都不能使溴的四氯化碳溶液褪色
C.石油分馏、煤的干馏均为物理变化
D.淀粉、蛋白质和天然橡胶均是天然高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于Zn(s) + H2SO4(aq) ═ ZnSO4(aq) + H2(g) △H=?的化学反应,下列叙述不正确的是 ( )

A、反应过程中能量关系如图所示,则该反应为放热反应
B、化学反应的反应热与反应方程式的计量数有关
C、若将该反应设计成原电池,锌为负极
D、若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是化学实验室中常见的有机物,它易溶于水并有特殊香味,B的产量可衡量一个国家石油化工发展的水平,并能进行如图所示的多种反应。
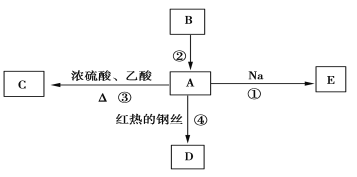
(1)写出A的化学式________。
(2)写出下列反应的化学方程式
反应①___________________________________________________________;
反应③_________________________________________________________;
反应④___________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com