
对可逆反应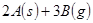

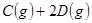 △H
△H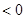 ,在一定条件下达到平衡,下列有关叙述正确的是
,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动;②升高温度,平衡向逆反应方向移动,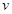 (正)减小;③压强增大一倍,平衡不移动,
(正)减小;③压强增大一倍,平衡不移动,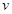 (正)、
(正)、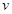 (逆)不变;④增大B的浓度,
(逆)不变;④增大B的浓度,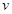 (正)
(正) (逆);⑤加入催化剂,B的转化率提高
(逆);⑤加入催化剂,B的转化率提高
| A.①② | B.③ | C.④ | D.④⑤ |
科目:高中化学 来源: 题型:
 (2009?安徽模拟)A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素原子的电子层数为n,最外层电子数为2n+1,A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物.回答下列问题:
(2009?安徽模拟)A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素原子的电子层数为n,最外层电子数为2n+1,A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物.回答下列问题:| 3 |
| 2 |
| 3 |
| 2 |
| 4 |
| a2 |
| 4 |
| a2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省安阳一中高二上学期期末考试化学试卷(带解析) 题型:填空题
(8分)对可逆反应aA(g)+bB(g)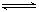 cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系:
cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系: (为一常数),K称为化学平衡常数,它的值只与温度有关。现有反应:CO(g)+H2O(g)
(为一常数),K称为化学平衡常数,它的值只与温度有关。现有反应:CO(g)+H2O(g)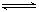 CO2(g)+H2(g),△H<0。在850℃时,K=1。
CO2(g)+H2(g),△H<0。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K 1(填“大于”、“小于”或“等于”)。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:①当x=5.0时,上述平衡向 (填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
(3)在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a b(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源:2014届河南省高二上学期期末考试化学试卷(解析版) 题型:填空题
(8分)对可逆反应aA(g)+bB(g)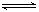 cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系:
cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系: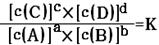 (为一常数),K称为化学平衡常数,它的值只与温度有关。现有反应:CO(g)+H2O(g)
(为一常数),K称为化学平衡常数,它的值只与温度有关。现有反应:CO(g)+H2O(g)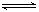 CO2(g)+H2(g),△H<0。在850℃时,K=1。
CO2(g)+H2(g),△H<0。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K 1(填“大于”、“小于”或“等于”)。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:①当x=5.0时,上述平衡向 (填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
(3)在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a b(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省泰州市高三第一次模拟考试化学卷 题型:实验题
(14分)本世纪,人类社会将逐渐步入氢经济时代。目前大规模产氢方式仍是化学制氢。
I、催化重整制氢
以甲醇为例,反应制氢气的一般途径有:
CH3OH(l)=2H2(g)+CO(g) △H1=+128 kJ·mol-1
CH3OH(l)+H2O(l)=3H2(g)+CO2(g) △H2= a kJ·mol-1
已知:H2(g)+1/2O2(g)=H2O(l) △H=-286 kJ·mol-1
为求得△H2,还要知道 的燃烧热,若其燃烧热为△H=一283 kJ·mol-1,则△H2= 。
Ⅱ、金属置换制氢
(1)研究表明,刚切割的金属表面具有很高的反应活性。当铝或铝合金在水中被切割或碾碎的时候,可以持续地释放出氢气。使用铝与水反应制氢气比使用其它活泼金属与水反应制氢气的优点有:①价廉,成本较低;② 。
(2)利用天然气重整得到的CO、H2混合气对金属氧化物进行还原,然后将金属与水反应放出氢气,由此达成一个良性循环。根据高中所学的知识合理预测该金属单质,并写出该金属在加热的条件下与水蒸汽反应的化学方程式 。
III、太阳能制氢
利用光能分解水必须要有催化剂的参与。下列有关催化剂的说法正确的是
A.使用高效催化剂分解水制得H2的同时还可以获得能量
B.使用高效催化剂后常温下水可以自发分解
C.硅胶具有多孔结构,有较大的表面积,常用做催化剂的载体
D.对于可逆反应,催化剂在增大正反应速率的同时也增大逆反应速率
Ⅳ、配位氢化物制氢
在硼氢化钠(NaBH4)水溶液中加入特定催化剂后,可以迅速地发生水解反应生成偏硼酸钠和氢气。请写出此水解反应的化学方程式 。
将无水偏硼酸钠、氢化镁(MgH2)放入球磨设备中,通入氩气或氢气并保持压强100~500 kPa研磨0.5~4 h,即可得到硼氢化钠。研磨过程中需要通入氩气或氢气并保持压强100~500 kPa的目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com