
| A、CO2 |
| B、NH3 |
| C、SO3 |
| D、Cl2 |


科目:高中化学 来源: 题型:
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:
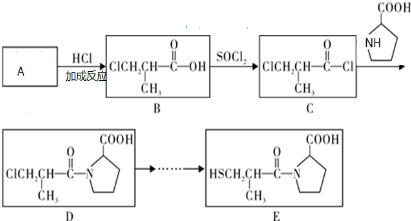
| NaOH |
| △ |
| H+ |
| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液体呈无色 |
| B、液体分两层,上层为紫色,下层接近无色 |
| C、液体呈紫红色 |
| D、液体分两层,上层接近无色,下层为紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯硝化,苯酚和溴水反应,皂化反应,乙烯与溴水反应 |
| B、酯的水解,酯化反应,乙醇和氢卤酸反应,乙醇和浓硫酸加热至140℃时的反应 |
| C、淀粉在硫酸存在下制葡萄糖,醛的氧化或还原 |
| D、纤维素水解,浓硫酸和乙醇在170℃时的反应,蛋白质水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
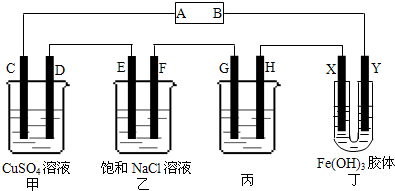
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com