
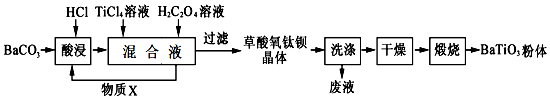
分析 用固体配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶、贴标签,据此选择需要的仪器及正确操作步骤.
解答 解:利用实验室的固体氯化钠试剂,配制500mL 0.4mol/L 的NaCl溶液,首先需要计算所需固体氯化钠的质量:m(NaCl)=0.5L×0.4mol/L×58.5g/mol=11.7g,然后用托盘天平称量固体氯化钠11.7g,将氯化钠在烧杯中溶解,用玻璃棒不断搅拌,冷却后,将氯化钠溶液用玻璃棒引流转移入容量瓶中,洗涤烧杯和玻璃棒两次,洗涤液一并转入容量瓶中,振荡,然后直接向容量瓶中加水到液面接近刻度1~2cm处;改用胶头滴管加水到瓶颈刻度处,使溶液凹液面正好与刻度线相切,把容量瓶塞好,上下颠倒,反复摇匀,装入干燥的试剂瓶中,贴上标签,注明名称、浓度、体积,用到的仪器依次为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管;
故答案为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管;
步骤为:
①计算:所需固体氯化钠的质量:m(NaCl)=0.5L×0.4mol/L×58.5g/mol=11.7g.
②用托盘天平称取固体氯化钠11.7g.
③将固体氯化钠放入烧杯中,并加入少量的蒸馏水用玻璃棒搅拌使之溶解.
④将氯化钠溶液用玻璃棒引流转移入容量瓶中.
⑤洗涤烧杯和玻璃棒两次,洗涤液一并转入容量瓶中,振荡.
⑥然后直接向容量瓶中加水到液面接近刻度1~2cm处;改用胶头滴管加水到瓶颈刻度处,使溶液凹液面正好与刻度线相切.
⑦把容量瓶塞好,上下颠倒,反复摇匀.
⑧装入干燥的试剂瓶中,贴上标签,注明名称、浓度、体积.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理是解题关键,注意操作步骤及仪器的选择.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、Br-、CO32- | B. | Br-、CO32-、Cl- | C. | CO32-、Br-、Cl- | D. | Br-、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
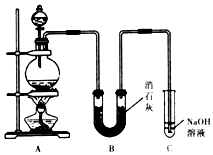 某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取漂白粉,据此回答下列问题:
某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取漂白粉,据此回答下列问题: MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O CaCl2+Ca(ClO)2+2H2O
CaCl2+Ca(ClO)2+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Cu2+、Cl-、NO3- | B. | K+、Na+、SO32-、S2- | ||
| C. | K+、Na+、AlO2-、SO42- | D. | Ba2+、Fe2+、NO3-、Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com