
| 天气情况 | 平均风速(m/s) | 空气中SO2的平均含量(mg/L) |
| 雨前 | ||
| 雨后 | ||
| 晴 | ||
| 晴 |
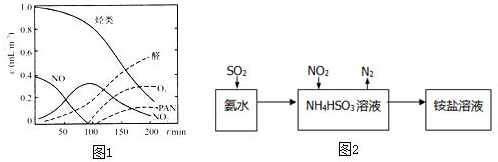
分析 (1)途经一:当雨水的pH<5.6时称为酸雨,硫酸型“酸雨”的形成过程可近似地看成是:排放到空气中的二氧化硫与潮湿空气中的氧气和水蒸气,在空气中粉尘的催化下化合生成硫酸;途径二:是空气中的二氧化硫气体在粉尘做催化剂的条件下生成三氧化硫,三氧化硫再与雨水形成酸雨;
(2)①根据SO2能和水反应;②根据风速越大,气体扩散速度越大;
(3)依据二氧化硫的性质:是一种酸性氧化物可以和碱反应,二氧化硫溶于水得亚硫酸,酸性强于碳酸,所以可以和碳酸钠溶液反应;
(4)①根据反应物结合质量守恒定律、电荷守恒书写离子方程式并判断生成物; ②根据元素守恒和化学方程式进行计算;
(5)依据图象分析可知NO,NO2、烃等在紫外线照射下生成O3、醛、PAN等污染物,从而形成光化学烟雾,而汽车尾气是排放氮氧化物和烃类的主要来源;
(6)①化合价升高值=化合价降低值=转移电子数,根据化合价的变化来确定电子转移数目;
②反应方程式中,系数之比等于物质的量之比;
(7)二氧化氮与水反应生成硝酸,硝酸具有强的氧化性,能够氧化亚硫酸氢根离子.
解答 解:(1)途径一:空气中的SO2可与雨水反应,发生SO2+H2O?H2SO3,H2SO3进一步被氧气氧化生成H2SO4,其反应方程式为:2H2SO3+O2=2H2SO4,硫酸溶在雨水中,使雨水呈酸性,形成酸雨;途径二:空气中的二氧化硫气体在粉尘做催化剂的条件下生成三氧化硫,三氧化硫再与雨水形成酸雨,故化学方程式为:2SO2+O2$\stackrel{浮尘}{?}$2SO3;SO3+H2O=H2SO4;
故答案为:SO2+H2O?H2SO3、2H2SO3+O2=2H2SO4或2SO2+O2$\stackrel{浮尘}{?}$2SO3、SO3+H2O=H2SO4;
(2)①SO2能和水反应,SO2+H2O?H2SO3,所以雨后空气中SO2的含量降低,可能是下雨时,二氧化硫溶于水,并与之反应降低了雨后空气中SO2的含量,
故答案为:可能是下雨时,二氧化硫溶于水,并与之反应降低了雨后空气中SO2的含量;
②风速越大,气体扩散速度越快,SO2浓度也就越小,
故答案为:风速越大,气体扩散速度越快,空气中SO2浓度越小;
(3)洗涤含SO2的烟气,根据酸性氧化物的性质选a.Ca(OH)2 b.Na2CO3,
故答案为:cd;
(4)①第一步反应中反应物有FeS2、O2和H2O,生成物有Fe2+和SO42-,根据氧化还原反应得失电子数目相等,则有2FeS2~7O2,根据电荷守恒,还应有生成H+,则反应的离子方程式为2FeS2+7O2+2H2O=4H++2Fe2++4SO42-,
故答案为:2FeS2+7O2+2H2O=4H++2Fe2++4SO42-;
②1kg含80%FeS2能生成二价铁离子的物质的量是$\frac{1000×80%}{120}$=6.67mol,
设消耗O2(标况)的体积为X,
4Fe2++O2+4H+=4Fe3++2H2O
4 22.4
6.67 X
$\frac{4}{6.67}$=$\frac{22.4}{X}$解得,X=37.352L
故答案为:37.352;
(5)依据图象分析可知NO,NO2、烃等在紫外线照射下生成O3、醛、PAN等污染物,从而形成光化学烟雾,而汽车尾气是排放氮氧化物和烃类的主要来源,故减少汽车尾气可以减少光化学烟雾的发生,
故答案为:O3、醛、PAN;
(6)①NO+O3═NO2+O2,生成1mol氧气转移电子是2mol,生成11.2L即0.5mol O2(标准状况)时,转移电子的物质的量是1mol,
故答案为:1;
②当n(NO2):n[CO(NH2)2]=3:2,即NO2和CO(NH2)2的系数之比是3:2,其方程式表示为:6NO2+4CO(NH2)2=7N2+8H2O+4CO2,
故答案为:6NO2+4CO(NH2)2=7N2+8H2O+4CO2;
(7)二氧化氮与水反应生成硝酸,硝酸具有强的氧化性,能够氧化亚硫酸氢根离子,反应的离子方程式为:2NO2+4HSO3-=N2+4SO42-+4H+,
故答案为:2NO2+4HSO3-=N2+4SO42-+4H+.
点评 本题综合考查了二氧化硫含量的测定以及二氧化硫的来源与危害、化学平衡图象,化学平衡影响因素及有关计算、电化学和热化学的综合知识,注意知识的归纳和整理是关键,题目难度中等.


科目:高中化学 来源: 题型:填空题



查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量使用薪柴为燃料不能体现低碳生活 | |
| B. | 实现化石燃料清洁利用,就无需开发新能源 | |
| C. | 铅蓄电池在放电过程中,负极质量减小,正极质量增加 | |
| D. | 钢管与电源正极连接,钢管可被保护 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+一定存在 | B. | 100mL溶液中含0.01molCO32- | ||
| C. | Cl-可能存在 | D. | Ba2+和Cl-一定不存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 如图是 A、B 两固体物质的溶解度曲线,在t1℃时,将25gA和25gB分别加到各有50g水中的甲、乙烧杯中,充分溶解,下列说法错误的是( )
如图是 A、B 两固体物质的溶解度曲线,在t1℃时,将25gA和25gB分别加到各有50g水中的甲、乙烧杯中,充分溶解,下列说法错误的是( )| A. | t1℃时,A、B两物质饱和溶液中溶质的质量分数相同 | |
| B. | 若A物质中混有少量B物质,可用降温结晶方法提纯A | |
| C. | 由t1℃升温至t2℃,甲烧杯里A物质溶液中溶质的质量分数不变 | |
| D. | 由t1℃升温至t2℃,乙烧杯中B物质溶液的质量不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com