
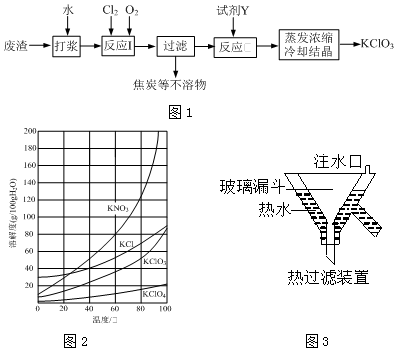
分析 工业废渣(含80%~90%的Ca(OH)2,其余为焦炭等不溶物),加入水打浆,通入氯气氯化和氢氧化钙反应在80℃生成氯酸钙和水,过滤掉焦炭等不溶物,向滤液中加入饱和KCl溶液,转化为KClO3的溶液,蒸发浓缩,冷却结晶,趁热过滤得到析出KClO3的晶体,据此分析作答.
解答 解:(1)反应I的目的是制备Ca(ClO3)2,发生的反应化学方程式为:2Ca(OH)2+2Cl2+5O2=2Ca(ClO3)2+2H2O;为使Cl2转化完全,可缓慢通入Cl2、O2(搅拌浆料或控制合适的温度);
故答案为:2Ca(OH)2+2Cl2+5O2=2Ca(ClO3)2+2H2O;缓慢通入Cl2、O2(搅拌浆料或控制合适的温度);
(2)若过滤时滤液出现浑浊,其可能的原因是:漏斗中液面高于滤纸边缘、滤纸已破损;
故答案为:AB;
(3)KNO3的溶解度随温度的升高而增大,防止产物KClO3中含有较多的KNO3杂质,所加试剂Y选用KCl而不用KNO3;
故答案为:防止产物KClO3中含有较多的KNO3杂质;
(4)①为防止滤液冷却析出的晶体堵塞漏斗,热过滤装置中玻璃漏斗的下端露出热水浴部分不宜过长;
故答案为:防止滤液冷却析出的晶体堵塞漏斗;
②已知:4KClO3$\frac{\underline{\;400℃\;}}{\;}$3KClO4+KCl,由KClO3制备高纯KClO4固体的实验方案:向坩埚中加入一定量的KClO3,控制温度400℃,使KClO3充分分解,将所得固体溶于水并煮沸至有大量固体析出,用热过滤装置过滤,并用冰水洗涤滤渣2~3次,在低温下干燥得KClO4固体;
故答案为:控制温度400℃,使KClO3充分分解,将所得固体溶于水并煮沸至有大量固体析出,用热过滤装置过滤,并用冰水洗涤滤渣2~3次.
点评 本题考查了物质的制备和分离提纯的过程分析判断,实验条件和物质性质的理解应用,实验设计和反应流程、原理理解是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 现有稀硫酸、纯碱、二氧化碳、铜片、食盐、生石灰、铁片和木炭粉8种物质.
现有稀硫酸、纯碱、二氧化碳、铜片、食盐、生石灰、铁片和木炭粉8种物质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
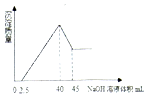 取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示.则原H2SO4物质的量浓度是( )
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示.则原H2SO4物质的量浓度是( )| A. | 1mol/L | B. | 2mol/L | C. | 3mol/L | D. | 4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1:2:1 | B. | 1:2:1:2 | C. | 4:2:2:1 | D. | 1:2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
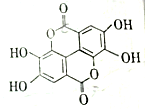 二缩双是一种广泛存在于各种软果、坚果等植物组织中的天然组分,其结构简式如图,二缩双在稀硫酸作用下水解不能得到的产物的类别是( )
二缩双是一种广泛存在于各种软果、坚果等植物组织中的天然组分,其结构简式如图,二缩双在稀硫酸作用下水解不能得到的产物的类别是( )| A. | 酚 | B. | 醛 | C. | 芳香族化合物 | D. | 羧酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 序号 | 起始温度t1/℃ | 终止温度 (t2)/℃ | 温差 (t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 氢气 | 原煤 (主要成份是C) | 汽油 (主要成份C8H18) |
| 热量(kJ) | 285.8 | 250.9 | 4910 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com