
CO2��CH4��������Ҫ���������壬ͨ��CH4��CO2��Ӧ�������ֵ��ѧƷ��Ŀǰ���о�Ŀ�ꡣ
��1��250��ʱ�������Ͻ�Ϊ��������4 L������ͨ��6 mol CO2��6 mol CH4���������·�Ӧ��CO2(g)��CH4(g) 2CO(g)��2H2(g)��ƽ����ϵ�и��������������±���
2CO(g)��2H2(g)��ƽ����ϵ�и��������������±���
| ���� | CH4 | CO2 | CO | H2 |
| ������� | 0.1 | 0.1 | 0.4 | 0.4 |
 2CO(g)��2H2(g) �ġ�H= ��
2CO(g)��2H2(g) �ġ�H= ��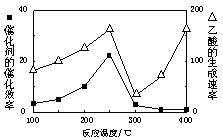
��1����64 ��+247.3 kJ��mol��1
��2�����¶ȳ���250��ʱ�������Ĵ�Ч�ʽ���
������Ӧѹǿ������CO2��Ũ��
��3Cu2Al2O4+32H++2NO3��=6Cu2++ 6Al3++2NO��+16 H2O
��3����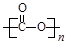 ��CO2+8e��+6H2O=CH4+8OH��
��CO2+8e��+6H2O=CH4+8OH��
���������������1����������CH4���ʵ���Ϊx����ƽ��ʱCH4��CO2��CO��H2���ʵ����ֱ�Ϊ(6-x)mol��(6-x)mol��2xmol��2xmol����CH4���������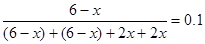 �����x=4������K=
�����x=4������K= 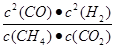 =
= 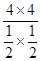 =64�����ɸ�˹���ɵá�H=(-890.3+2.8��2+566��2) kJ��mol��1=+247.3kJ��mol��1����2�����¶����ߣ��������Խ��͡���CO2(g)��CH4(g)
=64�����ɸ�˹���ɵá�H=(-890.3+2.8��2+566��2) kJ��mol��1=+247.3kJ��mol��1����2�����¶����ߣ��������Խ��͡���CO2(g)��CH4(g) CH3COOH(l)������ѹǿ�����������̼����Ũ�ȣ����������ת���ʡ���Cu2Al2O4��CuΪ+1�ۣ�Cu2Al2O4��������������ͭ����������NO��ˮ�����ݵ�ʧ������ȡ�����غ㡢�����غ���ƽ����3����CO2�����Ӿ۷�Ӧʱ������C=O˫���е�
CH3COOH(l)������ѹǿ�����������̼����Ũ�ȣ����������ת���ʡ���Cu2Al2O4��CuΪ+1�ۣ�Cu2Al2O4��������������ͭ����������NO��ˮ�����ݵ�ʧ������ȡ�����غ㡢�����غ���ƽ����3����CO2�����Ӿ۷�Ӧʱ������C=O˫���е� �����ۺϵ�
�����ۺϵ� ����CO2��ͭ�缫�Ͽ�ת��Ϊ���飬C�Ļ��ϼ���+4��Ϊ-4��������ԭ��Ӧ���ɵ��Ӻ͵���غ㡢�����غ�д���缫��Ӧʽ��
����CO2��ͭ�缫�Ͽ�ת��Ϊ���飬C�Ļ��ϼ���+4��Ϊ-4��������ԭ��Ӧ���ɵ��Ӻ͵���غ㡢�����غ�д���缫��Ӧʽ��
���㣺 ��ѧƽ�ⳣ�� ��˹���� ��ѧƽ���ƶ���ת���� ���ӷ���ʽ �߾��� �缫��Ӧʽ����д


 ��У��������ĩ��̾�ϵ�д�
��У��������ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ� ũҵ������������������Ҫ���ã� 
��1����ͼ��N2(g)��H2(g)��Ӧ����1mol NH3(g)�����������仯ʾ��ͼ����д��N2��H2��Ӧ���Ȼ�ѧ����ʽ�� ��
��2������֪�������ݣ�
| ��ѧ�� | H��H | N��N |
| ����/kJ��mol��1 | 435 | 943 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��14�֣�������һ�������Դ����������ȡ�봢��������Դ����������о��ȵ㡣
��1���Լ���Ϊԭ����ȡ�����ǹ�ҵ�ϳ��õ����ⷽ������֪��
CH4(g)��H2O(g) ===CO(g)��3H2(g) ��H��+206.2 kJ/mol
CH4(g)��CO2(g) ===2CO(g)��2H2(g) ��H��+247.4 kJ/mol
CH4(g)��H2O(g)��Ӧ����CO2(g)��H2(g)���Ȼ�ѧ����ʽΪ ��
��2��������(FeS2)ȼ�ղ�����SO2ͨ�����е�ѭ�����չ��̼�����H2SO4��������H2��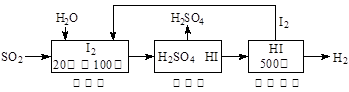
��֪1g FeS2��ȫȼ�շų�7.1 kJ������FeS2ȼ�շ�Ӧ���Ȼ�ѧ����ʽΪ ��
��ѭ�����չ��̵��ܷ�Ӧ����ʽΪ ��
��3���������[CO(NH2)2]�ļ�����Һ�����װ��ʾ��ͼ��ͼ�������и�Ĥ����ֹ����ͨ��������������Ϊ���Ե缫�������ʱ�������ĵ缫��ӦʽΪ ��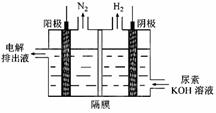
��4��������H2���ϡ������Ͻ���Ϊ��ظ�������(��MH��ʾ)��NiO(OH)��Ϊ����������ϣ�KOH��Һ��Ϊ�������Һ�����Ƶø��������������������ء���س�ŵ�ʱ���ܷ�ӦΪ��
NiO(OH)��MH Ni(OH)2��M
Ni(OH)2��M
�ٵ�طŵ�ʱ�������ĵ缫��ӦʽΪ ��
�ڳ�����ʱ��Ni(OH)2ȫ��ת��ΪNiO(OH)����������罫��һ���缫����O2��O2��ɢ����һ���缫�����缫��Ӧ�����ģ��Ӷ�������������������ر�ը����ʱ�������ĵ缫��ӦʽΪ ��
��5��Mg2Cu��һ�ִ���Ͻ�350��ʱ��Mg2Cu��H2��Ӧ������MgCu2�ͽ���һ�ֽ���Ԫ�ص��⻯����������������Ϊ0.077����Mg2Cu��H2��Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
1��һ������﮵���ǽ���ѧʽΪLi4Ti5O12��������Ϊ��ص��������ϣ��ڷŵ�Ĺ����б�Ϊ��ѧʽΪLi4Ti5O12�����ʡ�
��Li4Ti5O12��TiԪ�صĻ��ϼ�Ϊ ��﮵�ص�ͻ���ŵ��� ��
�ڸ�﮵����һ�ֶ��ε�أ��ŵ�ʱ�ĸ�����ӦʽΪ �����ʱ��������ӦʽΪ ��
��2����������ԭ�ζ����ⶨ�Ʊ��õ���TiO2�����е�TiO2��������������һ�������£���TiO2�ܽⲢ��ԭΪTi3+������KSCN��Һ��Ϊָʾ������NH4Fe��SO4��2����Һ�ζ�Ti3+��ȫ������Ti4+��
��TiCl4ˮ������TiO2��xH2O�Ļ�ѧ����ʽΪ ��
�ڵζ��յ�������� ��
�۵ζ�����ʱ����ȡTiO2����0��2g������0.1mol��L-1 NH4Fe��SO4��2����Һ20ml����TiO2����������Ϊ____ ��
�����ڵζ��յ㣬��ȡ�ζ��̶ܿ�ʱ�����ӱ���Һ��Һ�棬ʹ��ⶨ��� ���ƫ����ƫС������Ӱ�족��o
��3����֪��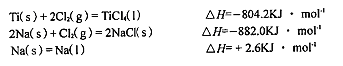
��TiCl4��I��+4Na��l��=Ti��s��+4NaCl��s���ġ�H= KJ��mol-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
I����ͼ��ʾ4��̼ԭ�����ϵķ�ʽ��С���ʾ̼ԭ�ӣ�С����ʾ��ѧ��������̼ԭ��������Ļ�ѧ�����������ϡ�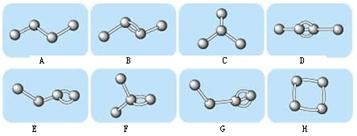
��1��ͼ�������������� �����ţ�������ϩ������ �����ţ���
��2����ͼ����B��Ϊͬ���칹�嵫������ͬ��������ʵ��ǣ� �������ţ�
II���α�������?���֡���Ŀ������һ�����ݣ��ƻ�1mol�����еĻ�ѧ����Ҫ����436kJ�������ƻ�1/2mol�����еĻ�ѧ����Ҫ����249kJ���������γ�ˮ������1 mol H��O���ܹ��ͷ�463kJ������
��ͼ��ʾ������������Ӧ�����������ı仯���뽫ͼ�Т١��ڡ��۵������仯����ֵ�������±ߵĺ����ϡ�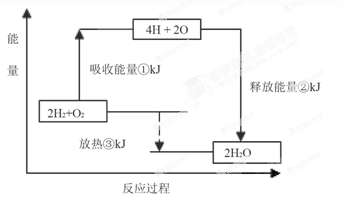
�� kJ���� kJ���� kJ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��Դ���ִ���ᷢչ��֧��֮һ��
��1����ѧ��Ӧ�е������仯��ͨ����Ҫ����Ϊ�����ı仯��
�����з�Ӧ�У����ڷ��ȷ�Ӧ����___________������ţ���
a. Ba��OH��2��8H2O��NH4Cl��Ͻ���
b. ��������ʯ��ʯ
c. �������ᷴӦ
��ijͬѧ��������ͼ��ʾʵ�飬����ϡ�������ռ���Һ�кͷ�Ӧ�������仯��ʵ���������Ӧ�¶����ߣ��ɴ��жϸ÷�Ӧ��_______������ȡ����ȡ�����Ӧ�������ӷ���ʽ��_______________��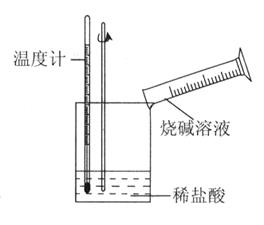
��2���������ִ����Ӧ����㷺����Դ֮һ��
��ͼ��ʾ��ԭ���װ���У��为����_____________________���������ܹ��۲쵽��������____________________________�������ĵ缫��Ӧʽ��_________________________��
ԭ��ع���һ��ʱ���������п6.5g����ų�����__________g��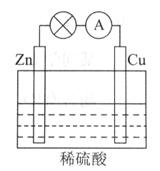
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ҵ�ϳɰ����Ʊ�����һ��������������������£�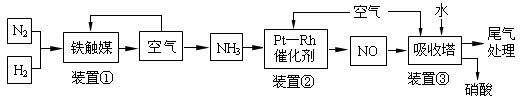
��ش��������⣺
��1��ij����С���о����������������������£��ı���ʼ�����������ʵ������Է�ӦN2(g)��3H2(g) 2NH3(g) ��H����92.4 kJ��mol-1��Ӱ�졣ʵ������ͼ��ʾ����ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�����
2NH3(g) ��H����92.4 kJ��mol-1��Ӱ�졣ʵ������ͼ��ʾ����ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�����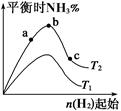
��ͼ����T2��T1�Ĺ�ϵ�ǣ�T2 T1(�>������<������=������ȷ����)��
�ڱȽ���a��b��c����������ƽ��״̬�У�N2��ת������ߵ��� (����ĸ)��
��Ҫʹ��Ӧ�İٷֺ������������ʼ��ϵ��ԭ��Ͷ�ϱ�n(H2)/n(N2) 3���� ��>������<������=������ȷ���������������ݻ���Ϊ1 L����ʼ״̬n(H2)="3" mol����Ӧ�ﵽƽ��ʱH2��ת����Ϊ60%�����������(T2)����Ӧ��ƽ�ⳣ��K= �����������С�������λ��
��2����֪��N2(g)��O2(g) 2NO(g) ��H����180.5 kJ��mol-1
2NO(g) ��H����180.5 kJ��mol-1
2H2(g)��O2(g) 2H2O(g) ��H����483.6 kJ��mol-1
2H2O(g) ��H����483.6 kJ��mol-1
����17 g�����������侭��������ȫ��Ӧ������һ�����������ˮ��������ù��������ų�������Ϊ kJ��
��3����װ�â��У�NH3��O2��145��Ϳ�ʼ���з�Ӧ���ڲ�ͬ�¶Ⱥʹ������������ɲ�ͬ�������ͼ��ʾ����
�¶Ƚϵ�ʱ���� Ϊ�����¶ȸ���900��ʱ��NO�����½��Ŀ���ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
�����������Ǵ�����Ⱦ����Ҫ���ء�
��1�������ŷŵ�β���к�NO������NO�ķ�Ӧ�Ļ�ѧ����ʽΪ ��
��2����ȡ��ԭ������̿�ۿɽ��������ﻹԭ��
��֪�� N2(g)��O2(g)=2NO(g) ��H����180.6 kJ��mol��1
C(s)��O2(g)=CO2(g) ��H����393.5 kJ��mol��1
��Ӧ C(s)��2NO(g)=CO2(g)��N2(g) ��H��________kJ��mol��1��
��3����NO2�������N2Ҫ�ҵ��ʺϵ�����G���ʵ��ķ�Ӧ������GӦΪ ����д������������ԭ����������ʽ��X����Ϊ����Ⱦ�����ʣ�ϵ��n����Ϊ0��
NO2 + G 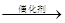 N2 + H2O + nX��δ��ƽ�ķ�Ӧʽ����
N2 + H2O + nX��δ��ƽ�ķ�Ӧʽ����
���л������У�����������Ӧʽ�е�G�� ����д��ĸ����
a��NH3 b��CO2 c��SO2 d��CH3CH2OH
��4������ˮ����������Ⱦ�ķ����ǣ�
�ٴ����������У���H2��NO3-��ԭΪN2��һ��ʱ�����Һ�ļ���������ǿ����Ӧ�����ӷ���ʽΪ�� ��
�������������£��绯ѧ����NO3-��ԭ������ͼ����Դ����Ϊ�� ��ѡ�A����B������������ӦʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��������;�㷺����¯�������ܷ�ӦΪ��Fe2O3��s��+3CO��g�� 2Fe��s��+3CO2��g������ش��������⣺
2Fe��s��+3CO2��g������ش��������⣺
��1��һ���¶��£�������̶����ܱ������з���������Ӧ�������жϸ÷�Ӧ�Ѿ��ﵽƽ����� ��
| A���ܱ���������ѹǿ���� |
| B���ܱ������л�������ƽ��Ħ���������� |
| C���ܱ������л��������ܶȲ��� |
| D��c��CO��= c��CO2�� |
 2Fe3O4��s��+CO2��g�� ��H="�C47" kJ/mol
2Fe3O4��s��+CO2��g�� ��H="�C47" kJ/mol 3FeO��s��+CO2��g�� ��H=" +19" kJ/mol
3FeO��s��+CO2��g�� ��H=" +19" kJ/mol Fe��s��+CO2��g�� ��H="�C11" kJ/mol
Fe��s��+CO2��g�� ��H="�C11" kJ/mol 2Fe��s��+3CO2��g���ġ�H= ��
2Fe��s��+3CO2��g���ġ�H= ��| �¶� | 250�� �� 600�� �� 1000�� �� 2000�� |
| ��Ҫ�ɷ� | Fe2O3 Fe3O4 FeO Fe |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com