
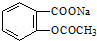 转变为
转变为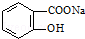 的方法为( )
的方法为( )| A. | 溶液加热,通入足量的HCl | |
| B. | 与足量的NaOH溶液共热后,再通入CO2 | |
| C. | 与稀H2SO4共热后,加入足量的Na2CO3 | |
| D. | 与稀H2SO4共热后,加入足量的NaOH |
分析 将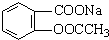 转变为
转变为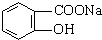 ,-COONa不变,则先发生碱性条件下水解,再将酚钠转化为酚-OH,以此来解答.
,-COONa不变,则先发生碱性条件下水解,再将酚钠转化为酚-OH,以此来解答.
解答 解:A.溶液加热并通入足量HCl,酯基和-COONa都反应,应该生成-OH、-COOH,故A错误;
B.加入NaOH溶液并加热,酯基和NaOH反应生成酚钠,然后再通入二氧化碳,生成-OH,故B正确;
C.和稀硫酸混合,-COONa、酯基都反应分别生成-COOH、-OH,然后加入足量的碳酸钠,碳酸钠和酚羟基、羧基都反应,故C错误;
D.和稀硫酸反混合,-COONa、酯基都反应分别生成-COOH、-OH,然后加入足量NaOH,羧基和酚羟基都和NaOH反应,故D错误;
故选B.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重酚、羧酸、酯性质的考查,注意强酸制取弱酸的反应,注意酚羟基能和碳酸钠反应但和碳酸氢钠不反应,为易错点.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
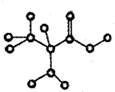 如图是某有机物简易球棍模型,已知它只含有C、H、O、N四种元素,下列关于该有机物的说法正确的是( )
如图是某有机物简易球棍模型,已知它只含有C、H、O、N四种元素,下列关于该有机物的说法正确的是( )| A. | 分子式为C3H7NO | |
| B. | 不能和NaHCO3溶液反应生成CO2 | |
| C. | 该分子中至少存在5个原子一定共面 | |
| D. | 可以与醇发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-己烯能使KMnO4(H+)溶液褪色 | |
| B. | 汽油、煤油、柴油和植物油都是碳氢化合物 | |
| C. | 乙烯、苯都可与溴水发生加成反应 | |
| D. | 乙烯和聚乙烯都能发生加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
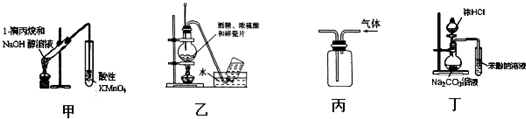
| A. | 用甲装置检验1-溴丙烷消去产物 | |
| B. | 实验室用乙装置制取乙烯 | |
| C. | 用丙装置收集甲烷气体 | |
| D. | 用丁装置证明酸性强弱:盐酸>碳酸>苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的金属性 X<Y | |
| B. | W的氢化物比同族其它元素的氢化物稳定,是因为W的氢化物中存在氢键 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
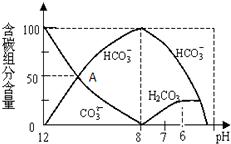 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com