
(10分)表1是元素周期表的一部分(注意:以下各空所涉及的元素填元素符号,不能用字母代替) 表1
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O族 |
1 |
|
|
|
|
|
|
|
|
2 |
|
|
| G | H |
| D |
|
3 | B |
| C |
|
| I | E |
|
4 | F | A |
|
|
|
|
|
|
(1)A-H八种元素中(填化学式)
(a)原子半径最小的元素是 ,还原性最强的单质是
(b)最高价氧化物对应水化物酸性最强的是 。
(2)G元素的最高价氧化物的结构式 ;I元素的气态氢化物属于 (极性或非极性)分子;H元素的气态氢化物的空间构型是 .
(3) C元素的离子结构示意图 ,用电子式表示AD2的形成过程 .
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |




查看答案和解析>>
科目:高中化学 来源: 题型:


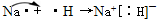




查看答案和解析>>
科目:高中化学 来源: 题型:
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:

| 元 素 | D | E | |
| 电离能 /kJ?mol-1 |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:表I是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
表I

表Ⅱ是一些气态基态原子的第一、二、三、四级电离能(kJ?mol-1):
表Ⅱ
| 锂 | X | Y | |
| 第一电离能 | 519 | 502 | 580 |
| 第二电离能 | 7296 | 4570 | 1820 |
| 第三电离能 | 11799 | 6920 | 2750 |
| 第四电离能 | 9550 | 11600 |
请根据上述信息,回答下列问题:
(1)为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量_____。
(2)表中Y可能为以上13种元素中的_____ (填写字母)元素。用元素符号表示 X和j形成的化学键种类最多的一种化合物的化学式_____。
(3)根据构造原理,用电子排布式表示e的特征电子构型_____。
(4)以上13种元素中,_____ (填写字母)元素原子失去核外第一个电子需要的能量最多。
(5)i元素另一元素形成的化合物其晶体有两种结构,其中一种结构与金刚石相似,该结构的晶体属_____晶体,若使其熔化,需破坏的作用力为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com