
| A. | 酸碱中和反应 | B. | Ba(OH)2•8H2O与NH4Cl晶体的反应 | ||
| C. | 黑火药爆炸 | D. | 实验室制取氢气 |
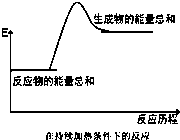
分析 当反应物的总能量高于生成物的总能量时,反应为放热反应;反之当反应物的总能量低于生成物的总能量时,反应为吸热反应,图象中反应物能量低于生成物,判断反应为吸热反应,结合选项反应特征分析判断即可.
解答 解:由图可知,此反应生成物的总能量高于反应物的总能量,故此反应为吸热反应;
A、酸碱中和反应为放热反应,故A不符合;
B、Ba(OH)2•8H2O与NH4Cl晶体的反应为吸热反应,常温下就能进行,不需要特殊条件,故B符合;
C、黑火药爆炸为放热反应,故C不符合;
D、实验室制备氢气是利用金属和稀硫酸发生氧化还原反应,反应过程中放热,故D不符合;
故选B.
点评 本题主要考查的是放热反应与吸热反应的判断,化学上把有热量放出的反应叫做放热反应,燃烧反应、中和反应等都是放热反应;把吸收热量的反应叫做吸热反应,一般分解反应、消石灰与氯化铵固体反应等是吸热反应,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | -317.3kJ/mol | B. | +317.3 kJ/mol | C. | -379.3kJ/mol | D. | -332.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器编号 | c(CO)/mol.L-1 | c(O2)/mol.L-1 | (CO2)/mol.L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
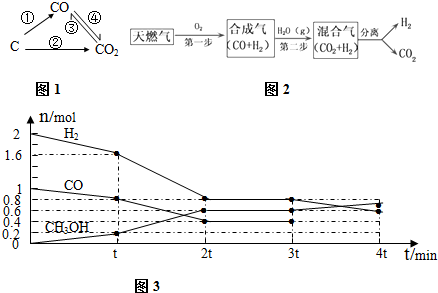
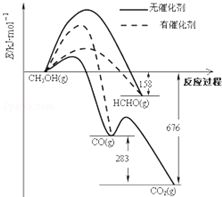 (1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图(反应物O2(g)和生成物H2O(g)略去).
(1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图(反应物O2(g)和生成物H2O(g)略去).| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )| A. | 甲、乙两烧杯中溶液的pH均保持不变 | |
| B. | 甲烧杯a电极反应式为:4OH--4e-═O2↑+2H2O | |
| C. | 电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀 | |
| D. | 当b极增重3.2g时,d极产生的气体为2.24L(标准状况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O+H2O=2NaOH | B. | Zn+H2SO4=ZnSO4+H2↑ | ||
| C. | 2Na+Cl2=2NaCl | D. | Cl2+2KI=2KCl+I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com