
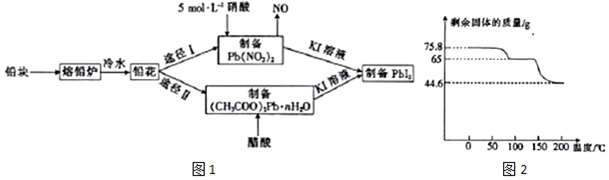
分析 用废铅块为原料合成PbI2的流程:为了增大与酸反应的接触面积,加快溶解反应速率,将铅块制成铅花,途径一:3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O,Pb(NO3)2+2KI=PbI2↓+2KNO3,途径二:Pb(NO3)2+2CH3COOH+nH2O=(CH3COO)2Pb•nH2O+2HNO3,(CH3COO)2Pb•nH2O+2KI=PbI2↓+2CH3COOK+nH2O.
(1)铅是碳的同族元素,且比碳多4个电子层,应为6个电子层,最外层4个电子,主族元素电子层数=周期序数,最外层电子数=主族族序数;
(2)根据影响反应速率的因素去分析,接触面积越大,反应速率越快,铅块制成铅花为了增大表面积,加快反应速率;铅和浓硝酸反应生成硝酸铜,二氧化氮和水,含等物质的量HNO3时,浓硝酸溶解的铅较少,且放出的污染气体较多;
(3)(CH3COO)2Pb溶液中(CH3COO)2Pb 为弱电解质与KI溶液反应生成PbI2 和醋酸钾;
(4)①图中起始固体质量为75.8g,则加热到100℃时完全失去结晶水的质量就是固体减轻的质量,求算出水的物质的量及醋酸铅的物质的量,根据两者的物质的量之比可确定n的值;
②醋酸铅继续加热分解剩余固体为铅的氧化物,可根据剩余固体质量及铅、碳原子守恒来确定有机物的摩尔质量,推测有机物的分子组成;
(5)根据酸碱中和的原理可计算出溶液中的H+的浓度,并结合关系式确定溶液里Pb2+的浓度,再计算Ksp.
解答 解:(1)铅是碳的同族元素,且比碳多4个电子层,应为6个电子层,最外层4个电子,位于周期表中第六周期第ⅣA族,
故答案为:六;IVA;
(2)接触面积越大,反应速率越快,将铅块制成铅花,是为了增大与酸反应的接触面积,加快溶解反应速率,铅与浓硝酸发生氧化还原反应,生成硝酸铅,二氧化氮和水,反应的化学方程式为Pb+4HNO3(浓)=Pb(NO3)2+2NO2↑+2H2O,与稀硝酸相比,含等物质的量HNO3时,浓硝酸溶解的铅较少,且放出的污染气体较多,
故答案为:增大接触面积,加快反应速率;用14 mol•L-1的浓硝酸反应时,含等物质的量HNO3时,浓硝酸溶解的铅较少,且放出的污染气体较多;
(3)(CH3COO)2Pb溶液中(CH3COO)2Pb 为弱电解质与KI溶液反应生成PbI2 和醋酸钾,反应的离子方程式为:(CH3COO)2Pb+2I-═PbI2↓+2CH3COO-,
故答案为:(CH3COO)2Pb+2I-═PbI2↓+2CH3COO-;
(4)①图中样品的起始质量为75.8g,根据固体残留率可知,100℃时剩余固体为65克,生成的水质量为75.8g-65g=10.8g,则醋酸铅与水的物质的量之比为$\frac{65g}{325g/mol}$:$\frac{10.8g}{18g/mol}$=1:3,则n=3,
故答案为:3;
②铅的氧化物质量为44.6克,醋酸铅的物质的量为=$\frac{65g}{325g/mol}$=$\frac{65}{325}$mol,有机物的质量为65g-44.6g=20.4g,此有机物分子内应含有四个碳原子,物质的量为$\frac{65}{325}$mol,摩尔质量为$\frac{20.4g}{\frac{65}{325}mol}$=102,根据原子守恒可知有机物的分子式为C4H6O3,结构简式为(CH3CO)2O;
故答案为:(CH3COO)2Pb $\frac{\underline{\;150-200℃\;}}{\;}$PbO+(CH3CO)2O;
(5)n(H+)=n(NaOH)=0.002500 mol•L-1×20.00mL×10-3L•mL-1=5.000×10-5mol
n[Pb2+(aq)]=$\frac{1}{2}$n(H+)=2.500×10-5mol
c(Pb2+)=$\frac{2.500×1{0}^{-5}mol}{25.00ml×1{0}^{-3}L/mol}$=1.000×10-3 mol•L-1
Ksp(PbI2)=c(Pb2+)•c2(I-)=4c3(Pb2+)=4×(1.000×10-3)3=4.000×10-9,
故答案为:4.000×10-9.
点评 本题考查制备实验方案设计,为高频考点,涉及反应速率影响因素、难溶物溶解平衡、溶度积计算等知识点,侧重考查学生分析计算能力,掌握基础是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
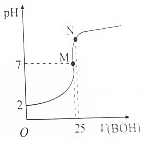 25℃时,向25mL 0.1000mol•L-1HA溶液滴加同浓度的BOH溶液,混合溶液pH随滴加BOH溶液的变化如下图所示.下列有关叙述错误的是( )
25℃时,向25mL 0.1000mol•L-1HA溶液滴加同浓度的BOH溶液,混合溶液pH随滴加BOH溶液的变化如下图所示.下列有关叙述错误的是( )| A. | BA溶液呈碱性 | |
| B. | 酸HA的电离常数约为0.0011 | |
| C. | M点时,c(B+)=c(A-)>c(H+)=c(OH-) | |
| D. | N点时加入10mL0.1000mol•L-1HA溶液,将促进A-的水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
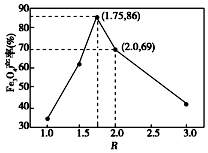
| 沉淀物 | Fe(OH)3 | Fe(OH)2 |
| 完全沉淀物PH | 3.0 | 8.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

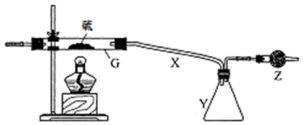
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
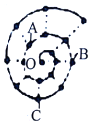 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“.”代表一种元素,其中O点代表氢元素,下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“.”代表一种元素,其中O点代表氢元素,下列说法中错误的是( )| A. | O与A、B、C均能形成两种化合物 | |
| B. | A元素位于元素周期表ⅥA族 | |
| C. | B元素是图中金属性最强的元素 | |
| D. | B、C最高价氧化物的水化物可以相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na的原子结构示意图: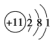 | |
| B. | 含有6个质子和7个中子的碳元素的核素符号:${\;}_{6}^{13}$C | |
| C. | 氮气的电子式::N:::N: | |
| D. | 用电子式表示氧化钠的形成过程: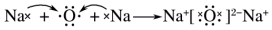 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒 | |
| B. | 25℃、1.01×105 Pa下,44g CO2中含有的原子数为3NA | |
| C. | 1 L 0.5mol/L Na2CO3 溶液中含有的CO32-数目为0.5NA | |
| D. | 1 mol Cl2与足量Fe反应,转移的电子数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com