
【题目】下列叙述正确的是( )
A. 反应AlCl3+4NaOH===NaAlO2+3NaCl+2H2O,可以设计成原电池
B. Zn和稀硫酸反应时,加入少量CuSO4溶液能加快产生H2的速率
C. 把Fe片和Cu片放入稀硫酸中,并用导线把二者相连,观察到Cu片上产生大量气泡,说明Cu与H2SO4能发生反应而Fe被钝化
D. Zn-Cu原电池工作过程中,溶液中H+向负极作定向移动
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】检验氯化氢气体中是否混有Cl2,可采用的方法是( )
A. 用干燥的蓝色石蕊试纸
B. 用干燥有色布条
C. 将气体通入硝酸银溶液
D. 用湿润的淀粉碘化钾试纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
一种工业合成氨的简易流程图如下:
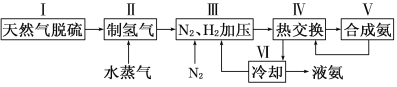
(1)在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是 。升高平衡体系的温度(保持体积不变),该反应 (填“逆向移动”正向移动”或“不移动”) 。
2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是 。升高平衡体系的温度(保持体积不变),该反应 (填“逆向移动”正向移动”或“不移动”) 。
(2)氨水、氯水中均存在多种微粒和多个平衡,请写出氯水中存在的一个化学平衡反应的离子方程式 。
(3)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是___________。
a.升高温度 b.增大压强
c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若2 mol CO和H2的混合气体(H2的体积分数为80%)与H2O反应,得到2.28mol CO、CO2和H2的混合气体,则CO转化率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量铜与足量浓硝酸充分反应,可以得到6.72L NO2气体(气体体积在标准状况下测定)。
(1)若反应后溶液体积为100mL,则所得溶液中Cu2+的物质的量浓度是多少?
(2)若改用排水法收集气体,则可收集到气体的体积为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,1L 1mol/LHF溶液中含HF分子数目为NA
B.2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g) △H=-a kJ·mol-1,将2mol CO2和6mol H2在一密闭容器中按照上述反应充分反应放出a kJ的热量
CH3CH2OH(g)+3H2O(g) △H=-a kJ·mol-1,将2mol CO2和6mol H2在一密闭容器中按照上述反应充分反应放出a kJ的热量
C.78gNa2O2固体中含阴离子数目为NA
D.25g质量分数68%的H2O2水溶液中含氧原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,不正确的是
A.用NaOH溶液除去铝箔表面的氧化膜,Al2O3 + 2OH-=2AlO2-+ H2O
B.向AlCl3溶液中加入过量氨水,Al3+ + 3NH3·H2O=Al(OH)3↓ + 3NH4+
C.用胃舒平(复方氢氧化铝)缓解胃酸(HCl)过多,OH-+ H+=H2O
D.向污水中投放明矾,生成能凝聚悬浮物的胶体,Al3+ + 3H2O![]() Al(OH)3 (胶体) + 3H+
Al(OH)3 (胶体) + 3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来验证元素周期律.
用过氧化氢的水溶液和二氧化锰制备氧气,并将其通入到氢硫酸(H2S的水溶液)中.

(1)过氧化氢的电子式:_______________;
(2)从图1中选择氧气的制备装置______,反应前需要的操作是:________________;
(3)该实验如何证明O的非金属性强于S(用化学方程式表示)_____________;
(4)你认为能证明Cl的非金属性强于S的是___________
a.S在常温下为固体而Cl2为气体 b.H2S不如HCl稳定
c.H2SO3的酸性弱于HClO3 d.S与H2化合不如Cl2与H2化合剧烈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列反应: (1) 2Fe3++2I-= 2Fe2++I2 (2) Br2 + 2Fe2+= 2Br-+2Fe3+,判断离子的还原性由强到弱的顺序是( )
A. Br- > I-> Fe2+ B. I- > Fe2+> Br- C. Fe2+> I-> Br- D. Br- > Fe2+> I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z都是第三周期元素,核电荷数依次增大,X的氧化物对应水化物为强碱,Z的原子半径最小。据此判断下列说法不正确的是 ( )
A. X是第ⅠA元素,Z是第ⅦA元素
B. X、Y、Z三种元素的最高化合价依次升高
C. Z的最高价氧化物对应的水化物是强酸
D. 如果Y的最高价氧化物的水化物难溶于水,则Y一定是Al
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com