
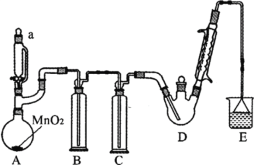
【题目】某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。查阅资料,有关信息如下:
①制备反应原理:C2H5OH + 4Cl2 → CCl3CHO+5HCl
可能发生的副反应:
C2H5OH + HCl → C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
(1)仪器a中盛放的试剂是_____ ;装置B的作用是__________ 。
(2)若撤去装置C,可能导致装置D中副产物________ (填化学式)的量增加;装置D可采用_________ 加热的方法以控制反应温度在70℃左右。
(3)装置E中可能发生的无机反应的离子方程式有____________________ 。
(4)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH。你认为此方案是否可行,为什么?_______________
(5)测定产品纯度:称取产品0.30 g配成待测溶液,加入0.1000 mol·L-1碘标准溶液20.00 mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000 mol·L-1 Na2S2O3溶液滴定至终点。进行平行实验后,测得消耗Na2S2O3溶液20.00 mL。则产品的纯度为_________。
滴定的反应原理:CCl3CHO +OH- → CHCl3 + HCOO-、 HCOO-+ I2 =H+ + 2I- + CO2↑ I2 + 2S2O32- = 2I-+ S4O62-
(6)请设计实验证明三氯乙酸的酸性比乙酸强。 __________________
【答案】浓盐酸 除去氯化氢 Cl3CCOOH、C2H5Cl 水浴 Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O 不可行,因为CCl3COOH可溶于乙醇、三氯乙醛,用过滤方法无法分离得到CCl3COOH 88.5% 分别测定0.1mol/L两种酸溶液的pH,三氯乙酸的pH较小
【解析】
分析题给信息可知:A装置利用二氧化锰和浓盐酸制备氯气,B装置用饱和食盐水除去HCl,C装置盛放浓硫酸干燥氯气,D装置为制备CCl3CHO的反应装置,E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl,以防止污染空气。
(1)A装置为用二氧化锰和浓盐酸制备氯气的反应装置,故仪器a中盛放的是浓盐酸,反应后生成的氯气中混有氯化氢气体,B装置中盛放饱和食盐水以除去氯化氢,故答案为:浓盐酸;除去氯化氢;
(2)氯气能与水反应生成HCl和HClO,撤去C后,易发生副反应:C2H5OH + HCl → C2H5Cl+H2O、CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl,从而导致D中副产物CCl3COOH、C2H5Cl的增加;反应温度需控制在70℃左右,可以考虑采取水浴加热,这样可使装置受热均匀,便于控制温度。故答案为:CCl3COOH、C2H5Cl;水浴;
(3)E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl,以防止污染空气。故离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O;答案为:Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O。
(4)由表中物质的物理性质可知,CCl3COOH可溶于水和三氯乙醛中,故用过滤方法无法分离得到CCl3COOH,故不可行,结合表中物质的沸点差异,应用蒸馏方法来进行分离。故答案为:不可行,因为CCl3COOH可溶于水和三氯乙醛中,用过滤方法无法分离得到CCl3COOH。
(5)根据滴定原理和I原子守恒,有:![]()
设与Na2S2O3溶液反应消耗I2的物质的量为x,则:
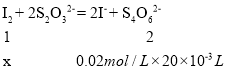
![]() 解得
解得![]() mol
mol
故与HCOO-反应消耗的I2的物质的量=0.002mol-0.0002mol=0.0018mol
根据CCl3CHO +OH- → CHCl3 + HCOO- HCOO-+ I2 =H+ + 2I- + CO2↑,可得关系式:CCl3CHO~HCOO-~I2
设CCl3CHO的物质的量为y,则:
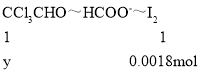
![]() ,解得y=0.0018mol
,解得y=0.0018mol
故产品的纯度=![]()
故答案为:88.5%
(6)比较三氯乙酸和乙酸的酸性强弱方法较多:如等物质的量浓度的三氯乙酸和乙酸,分别测量二者的pH值,可看到三氯乙酸的pH较小或pH相同的三氯乙酸和乙酸溶液,分别稀释10倍,三氯乙酸的pH变化大或测定等物质的量浓度的二者对应的强碱盐的碱性,可知乙酸盐的碱性更强等等,故答案为:分别测定0.1mol/L两种酸溶液的pH,三氯乙酸的pH较小。


科目:高中化学 来源: 题型:
【题目】下列化学用语表示正确的是
A. 碳酸的电离方程式:H2CO32H++CO32-
B. 碱性氢氧燃料电池负极的电极反应式:H2—2e-=2H+
C. 向FeBr2溶液中通入少量Cl2:2Br-+ Cl2= Br2+2Cl-
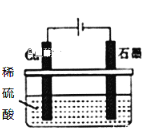
D. 如图所示,反应开始时的离子方程式:Cu+2H+![]() Cu2++H2↑
Cu2++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.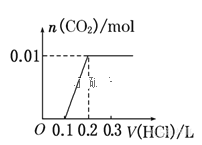 B.
B.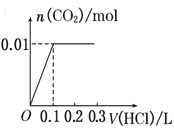
C.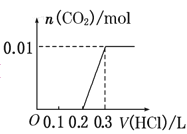 D.
D.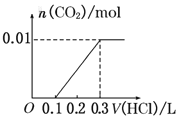
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察如图装置,下列说法错误的是
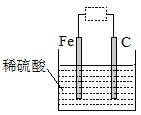
A.虚线框中接灵敏电流计,该装置可将化学能转化为电能
B.虚线框中无论是否接灵敏电流计,铁都要被腐蚀
C.虚线框中接直流电源,铁可能不易被腐蚀
D.虚线框中接灵敏电流计或接直流电源,铁都是负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL的某稀盐酸中滴入0.1 mol·L-1的羟胺溶液, 羟胺的电离方程式为:NH2OH+H2O ![]() NH3OH++OH-(25℃常温时, Kb=9.0×l0-9)。溶液中由水电离出的氢离子浓度随滴入羟胺溶液体积的变化如图(已知:lg3=0.5),下列分析正确的是
NH3OH++OH-(25℃常温时, Kb=9.0×l0-9)。溶液中由水电离出的氢离子浓度随滴入羟胺溶液体积的变化如图(已知:lg3=0.5),下列分析正确的是
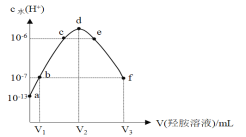
A.0.1 mol·L-1羟胺溶液的 pH=8.5B.b点溶液中:c(H+) =c(OH-)
C.d点对应溶液中存在:c(H+)=c (OH-)+c (NH2OH)D.该稀盐酸的浓度为0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁基橡胶可用于制造汽车内胎,合成丁基橡胶的一种单体A的分子为C4H8,A氢化后得到2-甲基丙烷。完成下列填空:
(1)A分子中的官能团的名称为___。
(2)写出将A通入下列两种溶液后出现的现象。
A通入溴水:___,
A通入溴的四氯化碳溶液:___。
(3)写出A氢化后产物2-甲基丙烷的同分异构体的结构简式:___。
(4)A可以聚合,写出A的聚合反应___(以反应方程式表示)。
(5)A发生烷基化反应生成一种烃B,将B完全燃烧后得到CO2和H2O的物质的量之比为8:9,由此可以确定B的化学式为___。通过对B的结构深入研究,发现其一卤代物只有4种,且碳链不对称。写出B的结构简式,并用系统命名法命名:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBH4是一种常见的还原剂。一种以H2、Na、硼酸三甲酯[B(OCH3)3]为原料,生产NaBH4的工艺流程如下:
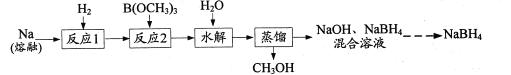
(1)下列措施能提高“反应1”的化学反应速率的有______(填字母)。
A.充分搅拌熔融钠
B.将熔融钠充分分散在石蜡油中
C.反应前排尽装置中的空气
(2)在浓硫酸作用下,B(OCH3)3可由B(OH)3和CH3OH发生酯化反应制得。浓H2SO4的作用是_____。
(3)“反应2”在240℃条件下进行,生成的产物是NaBH4和CH3ONa,写出该反应的化学方程式:____ 。“反应2”所用B(OCH3)3需充分干燥,原因是______。
(4)反应NaBH4+2H2O=NaBO2+4H2 可用于制取H2。一定浓度的NaBH4催化制氢的半衰期(溶液中NaBH4消耗一半时所需的时间)与溶液pH的关系如图所示:
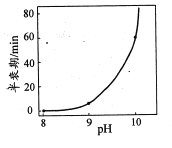
①NaBH4与水反应所得溶液呈碱性,原因是____。
②随着反应的进行,生成H2的速率逐渐减慢,原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是制备乙酸乙酯的两种装置,下列说法错误的是
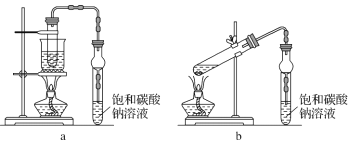
A.相比于 b,a装置具有副反应少、原料利用率高等优点
B.加入的浓硫酸要稍多于催化剂用量的原因是浓硫酸还起到吸水剂的作用,推动平衡正向进行
C.反应结束后,将收集到的产品倒入分液漏斗中,振荡、放气、静置、分液,然后从下口放出制备的产物
D.乙酸乙酯在饱和碳酸钠溶液中的溶解度较小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com