


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
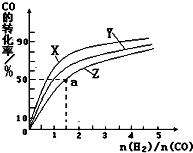 欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,pH=12的 Ba(OH)2溶液中含有的OH-数目为0.01 NA |
| B、9gH218O含有的中子数为5NA |
| C、常温常压下,28gC2H4、C3H6的混合气体中含有碳原子的数目为2NA |
| D、分子数为NA的CO、N2混合气体体积约为22.4L,质量为28g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com