
某有机物的结构简式为 ,该有机物不可能发生的化学反应是( )
,该有机物不可能发生的化学反应是( )
A.加成反应 B.酯化反应
C.氧化反应 D.水解反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
2013年12月5日中国辽宁舰航母编队中的登陆舰紧急逼停了擅闯南海禁航区的美海军“考本斯”号导弹巡洋舰,避免了两军舰艇相撞。据悉,美国“考本斯”号巡洋舰上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)做载热介质。下列有关说法不正确的是( )
A.自然界中没有游离的钠和铝
B.若铝钠合金投入水中得无色溶液,则n(Al)≤n(Na)
C.铝钠合金投入到水中,一定有偏铝酸钠生成
D.m g不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则铝的质量分数越小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是
A.凡是放热反应都是自发反应
B.凡是熵增大的反应都是自发反应
C.要判断反应进行的方向,必须综合考虑体系的焓变和熵变
D.过程的自发性不仅能用于判断过程的方向,还能确定过程是否一定能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
.在高中阶段化学学科中所涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四种,均符合勒夏特列原理,它们在工农业生产中都有广泛的应用。请回答下列问题:

Ⅰ:(1)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g) +CO2(g) CO(NH2)2 (l)+H2O(l).
CO(NH2)2 (l)+H2O(l).
① 已知该反应的平衡常数K195℃ < K165℃,则该反应的△H_______0(填“>”“=”或“<”)。
② 一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)n(NH3)/ n(CO2)=x,右图是氨碳比(x)与CO2平衡转化率(a)的关系。a随着x增大的原因是________。
③取一定量的NH3和CO2放在一个带活塞的密闭真空容器中在一定温度下反应达平衡,若在恒温、恒容
下充入气体He,CO(NH2)2(l)的质量_____(填“增加”、“减小”或“不变”)。
Ⅱ:(1)某温度下,纯水中c(H+) = 2.0×10-7mol/L,该温度下,0.9mol/L NaOH
溶液与0.1 mol/L HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的
pH=_________。
(2)向100 mL 0.10 mol/L CH3COOH的溶液中加入0.010 mol CH3COONa固体,溶
液pH增大,主要原因是(请用学过的平衡理论解释)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机物的说法,正确的是
( )
A.棉线和蚕丝都能水解生成葡萄糖
B.CH3CH2CH2CH3和CH3CH(CH3)2互为同分异构体
C.1 mol 甲烷和1 mol 氯气在光照条件下充分反应,生成1 mol CH3Cl
D.乙酸乙酯中含有的杂质乙酸可用NaOH溶液除去
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是立方烷的球棍模型,下列有关说法不正确的是
( )
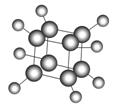
A.其一氯代物只有一种
B.其二氯代物有三种
C.在光照下,其能与氯水发生取代反应
D.它与苯乙烯(C6H5—CH===CH2)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
实验是化学研究的基础,关于下列各实验装置图的叙述中正确的是( )

①

② ③ ④
A.装置①:常用于分离互不相溶的液体混合物
B.装置②:可用于吸收NO2或HCl气体,并防止倒吸
C.装置③:先从b口进气集满二氧化碳,再从a口进气,可收集一氧化氮
D.装置④:可用来证明碳的非金属性比硅强
查看答案和解析>>
科目:高中化学 来源: 题型:
如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
| 序号 | 内容 |
|
| 1 | 常温下将铁丝放在干燥空气中一个月 | 干燥的铁丝表面依然光亮 |
| 2 | 常温下将铁丝放在潮湿空气中一小时 | 铁丝表面依然光亮 |
| 3 | 常温下将铁丝放在潮湿的空气中一个月 | 铁丝表面已变得灰暗 |
| 4 | 将潮湿的铁丝放在常温的氧气流中一小时 | 铁丝表面略显灰暗 |
| 5 | 将潮湿的铁丝放在高于常温的氧气流中一小时 | 铁丝表面已变得灰暗 |
| 6 | 将浸过氯化钠溶液的铁丝放在高于常温的氧气 | 铁丝表面灰暗程度比 |
下列有关说法不正确的是( )
A.上述实验中已明显发生电化学腐蚀的实验是3、4、5、6
B.影响金属腐蚀的外部因素有湿度、温度、O2的浓度、电解质等
C.实验6中铁被腐蚀的程度比5严重是因铁发生了如下反应:Fe-2e-===Fe2+
D.若保持铁表面干燥或将锌与铁相连,可 起到保护铁制品的作用
起到保护铁制品的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
含硫化合物在工业生产中有广泛的用途。
(1)对于可逆反应2SO2(g)+O2(g)  2SO3(g) △H<0,下列研究目的和图示相符的是
2SO3(g) △H<0,下列研究目的和图示相符的是
(填序号)
| 序号 | A | B | C | D |
| 目的 | 压强对平衡的影响 | 温度对转化率的影响 | 增加O2浓度对速率的影响 | 浓度对平衡常数的影响 |
| 图示 |
|
|
|
|
(2)在5000C有催化剂存在的条件下,向容积为2L的甲乙两个密闭容器中均充入2molSO2和1molO2。甲保持容积不变,乙保持压强不变,充分反应后,均达平衡状态,此时SO3的体积分数甲
乙。(填“>”“<”或“=” )
(3)向2L的甲容器中充入2molSO2、1molO2,测得SO2的平衡转化率与温度的关系如下图所示。
Ⅰ.在T1温度下,反应进行到状态D时,v正 v逆。(填“>”“<”或“=” )
Ⅱ.T3温度下,平衡时测得反应放出的热量为Q1,在相同温度下若再向容器中通入2molSO2、1molO2,重新达到平衡,测得反应又放出热量Q2 。则下列说法中正确的是 。(填序号)
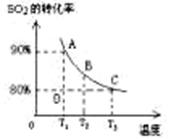 A.相同温度下新平衡时容器中的压强是原平衡时的两倍
A.相同温度下新平衡时容器中的压强是原平衡时的两倍
B.Q2一定大于Q1
C.新平衡时SO2的转化率一定大于80%
(4)在甲容器中充入一定量的SO2和1.100molO2,在催化剂作用下加热,当气体的物质的量减少0.315mol时反应达到平衡,此时测得气体压强为反应前的82.5%,则SO2的转化率为 。
(5)若用氢氧化钠溶液吸收SO2气体恰好得到酸式盐,已知该酸式盐溶液呈弱酸性,则溶液中各离子浓度由大到小的顺序为 。(用离子浓度符号表示)
(6)一定温度下,用水吸收SO2气体,若得到pH=5的H2SO3溶液,则溶液中亚硫酸氢根离子和亚硫酸根离子的物质的量浓度之比为 。
(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2mol/L,Ka2=6.0×10-3mol/L)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com