
下列有关强、弱电解质的说法中,正确的是 ( )
A.强电解质易溶于水,而弱电解质难溶于水
B.强电解质在水中的电离是放热过程,而弱电解质在水中的电离是吸热过程
C.强电解质在水溶液中完全电离,而弱电解质在水溶液中部分电离
D.强电解质在水溶液中导电能力强,而弱电解质在水溶液中导电能力弱
科目:高中化学 来源: 题型:
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( )
A.水既是氧化剂又是溶剂
B.放电时正极上有氢气生成
C.放电时OH-向正极移动 D.总反应为:2Li+2H2O=== 2LiOH+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,向2 L恒容密闭容器中充入1.0 mol A和1.0 mol B,反应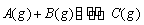 经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A、反应在前5 s的平均速率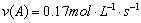
B、保持其他条件不变,升高温度,平衡时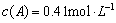 ,则反应的
,则反应的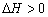
C、相同温度下,起始时向容器中充入2.0 mol C达到平衡时,C的转化率大于80%
D、相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各选项所述的两个量中,前者一定大于后者的是( )
A.纯水在100℃和25℃时pH
B.NH4Cl溶液中NH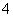 和Cl-的数目
和Cl-的数目
C.相同温度下,pH相同的NaOH溶液和Na2CO3溶液中由水电离出的c(OH-)
D.用0.1 mol/L的盐酸中和pH、体积均相同的氨水和NaOH溶液,所消耗盐酸的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应:mA(g)+nB(g)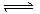 pC(g)+gD(g)的v-t图象如图甲所示;若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示。现有下列叙述:
pC(g)+gD(g)的v-t图象如图甲所示;若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示。现有下列叙述:
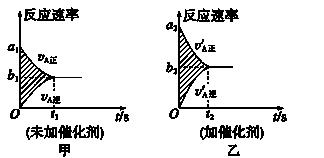
①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦甲图与乙图中阴影部分的面积相等
⑧图乙中阴影部分面积更大。则以上所述各项正确的组合为( )
A.②④⑥⑧ B.②④⑤⑦ C.②③⑤⑦ D.②③⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的例子方程式是
A.向次氯酸钙溶液通入过量CO2:Ca2++2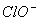 +CO2+H2O =CaCO3↓+2HClO
+CO2+H2O =CaCO3↓+2HClO
B.向次氯酸钙溶液通入SO2:Ca2++2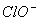 +SO2+H2O= CaSO3↓+2HClO
+SO2+H2O= CaSO3↓+2HClO
C.氢氧化钙溶液与碳酸氢镁溶液反应: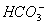 +Ca2++
+Ca2++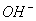 =CaCO3↓+H2O
=CaCO3↓+H2O
D.在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++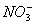 =3Fe3++NO↑+2H2O
=3Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D、E、F六种化合物,已知它们的阳离子有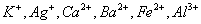 ,
, 阴离子有
阴离子有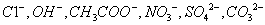 ,现将它们分别配成
,现将它们分别配成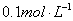 的溶液,进行如下实验:
的溶液,进行如下实验:
测得溶液A、C、E呈碱性,且碱性为A>E>C;
向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
向D溶液中滴加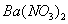 溶液,无明显现象;
溶液,无明显现象;
向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
实验②中反应的化学方程式是
;
(2)E溶液是 ,判断依据是
;
(3)写出下列四种化合物的化学式:A 、C 、
D 、F .
查看答案和解析>>
科目:高中化学 来源: 题型:
现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵,⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号) 。
(3)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是 。
(4)已知t℃,KW=1×12-13,则t℃(填“>”或“<”或“=”) 25℃。在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com