
分析 (1)根据稀释定律,稀释前后溶质的物质的量不变,据此计算混合溶液中H2SO4的物质的量浓度,混合后溶液中c(H+)=2c(H2SO4),再根据pH=-lgc(H+)计算;
(2)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铜、硫酸都完全反应,根据H原子守恒计算生成氢气物质的量,进而计算氢气体积,此时溶液中溶质为FeSO4,故c(Fe2+)=c(SO42-).
解答 解:(1)把2.0mol•L-1CuSO4和1.0mol•L-1H2SO4溶液各1L混合,根据稀释定律,稀释前后溶质的物质的量不变,则混合后溶液中c(H2SO4)=$\frac{1}{2}$×1.0mol/L=0.5mol/L,混合后溶液中c(H+)=2c(H2SO4)=2×0.5mol/L=1mol/L,则pH=-lgc(H+)=0,
答:混合溶液的H+浓度为1mol/L,pH值为0;
(2)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铜、硫酸都完全反应,根据氢原子守恒可知n(H2)=n(H2SO4)=1L×1mol/L=1mol,故氢气体积为1L×22.4L/mol=22.4L,
混合溶液中c(CuSO4)=$\frac{1}{2}$×2.0mol/L=1.0 mol/L,溶液中硫酸根来源于硫酸铜与硫酸电离,故 c(SO42-)=c(CuSO4)+c(H2SO4)=1mol/L+0.5mol/L=1.5mol/L,此时溶液中溶质为FeSO4,故c(Fe2+)=c(SO42-)=1.5mol/L,
答:标况下生成氢气体积为22.4L,此时溶液中Fe2+的物质的量浓度为1.5mol/L.
点评 本题考查物质的量浓度的有关计算、混合物计算,注意对公式的理解与灵活运用,(2)中注意利用守恒法解答,较好地考查学生分析计算能力.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只用溴水一种试剂可鉴别甲苯、乙烯、乙醇、四氯化碳四种物质 | |
| B. | 将乙醇加热到170℃可制得乙烯 | |
| C. | 用乙醇、冰醋酸及pH=0的硫酸加热可制乙酸乙酯 | |
| D. | 用酚酞可鉴别苯酚钠和乙醇钠两种溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O
+3H2O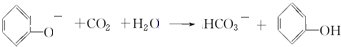 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6:3:2 | B. | 1:2:3 | C. | 3:2:1 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的状态 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m2 |
| 3 | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
| 4 | 50.0 | 6.0 | 粉末 | 25 | t2 | 14.9 |
| 5 | 50.0 | 8.0 | 粉末 | 25 | t3 | 19.3 |
| 6 | 50.0 | 10.0 | 粉末 | 25 | t4 | m3 |
| A. | t1>70 | |
| B. | m3=19.3 | |
| C. | 实验1、实验2与实验3探究的是温度对化学反应速率的影响 | |
| D. | 无法计算出硫酸的物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O的电子式: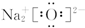 | B. | 硫离子的电子式: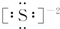 | ||
| C. | Na+的结构示意图: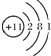 | D. | 碳-13:${\;}_{6}^{13}$C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com