
�����ѣ�DME��һ���������ȼ�ϣ����������γ�����������������ȣ��ŷŵ�NO2���٣�����������IJ��ͻ����ȼ�ϡ���ҵ������һ�����ϳɶ����ѵķ�Ӧ���£����ϴ���ΪCuO/ZnO/Al2O3����2CO��g)+4H2��g) CH3OCH3��g)+H2O��g) ��H= -204��7kJ/mol��
CH3OCH3��g)+H2O��g) ��H= -204��7kJ/mol��
��1������Ӧ�ں��¡���ѹ�½��У�����������˵���÷�Ӧ�ﵽƽ��״̬���� ��
A��CO��H2�����ʵ���Ũ�ȱ���1��2
B��CO���������ʵ���CH3OCH3���������ʵ�2��
C�������л�������������ֲ���
D�������л�������ƽ��Ħ���������ֲ���
E�������л��������ܶȱ��ֲ���
��2��600��ʱ��һ�����ϳɶ����ѹ������£�
CO��g)+2H2��g)=CH3OH��g) ��H1=-100��46kJ/mol
2CH3OH��g)=CH3OCH3��g)+H2O��g) ��H2
CO��g)+H2O��g)=CO2��g)+H2��g) ��H3=-38��7kJ/mol�����H2= ��
��3�����ϴ������Ʊ�����֮һ��Na2 CO3�����������Ʊ�1 mol/L������ͭ������п����������ˮ��Һ��Ȼ����ʢ��ȥ����ˮ���ձ���ͬʱ�μӻ����������Һ��1 mol/L��Na2CO3ˮ��Һ��70���½����ϡ���������ˣ�ϴ�ӳ����80���¸���12Сʱ��Ȼ��500���±���16Сʱ����д��������������������Na2CO3ˮ��Һ��Ӧ�����ӷ���ʽ�� ��
��4����DMEΪȼ�ϣ�����Ϊ�������������Ե������Һ���ö��Ե缫�Ƴ�ȼ�ϵ�أ���ͨ�������ĵ缫�ǵ�Դ�� ����������������ͨ��DME�ĵ缫��ӦΪ ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016�콭�ճ���һ�С�������ݼ���и�����У������ѧ���������棩 ���ͣ�ѡ����
��CO2�У�Mgȼ������MgO��C������˵����ȷ����
A��Ԫ��C�ĵ���ֻ���ڽ��ʯ��ʯī����ͬ��������
B��Mg��MgO��þԪ�����İ뾶��r(Mg2����>r(Mg��
C���ڸ÷�Ӧ�����£�Mg�Ļ�ԭ��ǿ��C�Ļ�ԭ��
D���÷�Ӧ�л�ѧ��ȫ��ת��Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���������컯��ѧ�߶�12���¿�����ѧ�Ծ��������棩 ���ͣ�ѡ����
1993�����й�ѧ�ߺ�������ѧ�ҹ�ͬ�ϳ�������������̼����ӣ���һ��������1334 ��̼ԭ�Ӻ�1148����ԭ�ӹ���.���ڴ����ʣ�����˵���϶��������
A����������� B���������ǹ�̬
C���ɷ����������ӳɷ�Ӧ D�����ܺ�381��̼̼����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������ʯ��ɽ������ѧ�߶������п��Ի�ѧ���������棩 ���ͣ������
�����������ʣ�����Ȳ �ڱ�����Һ ����ȩ �ܵ�����Һ �ݰ����ᡣ��ش�
��1������ˮ����ɫ���� ������ţ���ͬ����
��2���ܷ������ķ�Ӧ���� ��
��3���ܸ��巢���ӳɷ�Ӧ���� ��
��4���ܸ�������Һ����������Ӧ���� ��
��5���ܸ�������ˮ��Ӧ���ɰ�ɫ�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��������˳��һ��ѧ�����ϵ�һ��ģ�⿼�Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��25�桢1.01��105Pa�£���22gCO2ͨ�뵽750mL1.0mol/L��NaOH��Һ�г�ַ�Ӧ���ų�xkJ��������֪�������£�1mol CO2ͨ�뵽2L1.0mol/LNaOH��Һ�г�ַ�Ӧ���ų�y kJ����������CO2��NaOH��Һ��Ӧ����NaHCO3���Ȼ�ѧ����ʽ��ȷΪ
A��CO2��g��+NaOH��aq��=NaHCO3��aq����H=����2y-x��kJ/mol
B��CO2��g��+NaOH��aq��=NaHCO3��aq����H=����4x-y��kJ/mol
C��CO2��g��+NaOH��aq��=NaHCO3��aq����H=����2x-y��kJ/mol
D��CO2��g��+NaOH��aq��=2NaHCO3��aq����H=����8x-2y��kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��������«����һ����ѧ���������п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����Fe��FeO��Fe2O3��Fe3O4��ɵĻ���ȡһ������������100 mL2 mol/L�����ᣬ�����ǡ����ȫ�ܽ⣬�ų�a mL(��״����)�����壬������Һ�м���KSCN��Һ��Ѫ��ɫ���֡���ȡ�������ĸû�����������CO��ԭ�ɵ������ʵ�����Ϊ�� ��
A��11.2 g B�� 5.6g C�� 8.4g D��2.8g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������������һ��ѧ��һ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ֻ�������м��Ҷ�Ӧ�������������������ʵ�������( )
�� | �� | |
A | ����A�ķ����� | һ��A���ӵ����� |
B | ��״��������Ħ����� | ��״����������� |
C | ������� | �����ܶ� |
D | �DZ�״�������ʵ����� | ���ʵ�Ħ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ�����ݵ�һ��ѧ�߶������п��Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
±�����Ҫ�ɷ���MgCl2�������Fe3+��Fe2+��Mn2+�����ӡ���±��Ϊԭ�Ͽ��Ƶ���������þ������������ͼ��

��֪��Fe2+�����������״�����״���Һ�г�ȥ�����Գ���������ΪFe3+������Fe(OH)3������ȥ����Ҫ���Ʒ�����������ʣ�����ݱ�1�ͱ�2�ṩ�����ϣ���д�հף�
��1 �����������������pH | ��2 ��ѧ�Լ��۸�� | ||||
���� | ��ʼ���� | ������ȫ | �Լ� | �۸�Ԫ/�֣� | |
Fe(OH)3 | 2.7 | 3.7 | ƯҺ����25.2% NaClO�� | 450 | |
Fe(OH)2 | 7.6 | 9.6 | ˫��ˮ����30% H2O2�� | 2400 | |
Mn(OH)2 | 8.3 | 9.8 | �ռ��98% NaOH�� | 2100 | |
Mg(OH)2 | 10.0 | 11.1 | �����99.5% Na2CO3�� | 600 | |
��1���ڲ�����м�����Լ�X���ӱ�2��ѡ����___������˫��ˮ����ԭ����________________��
д������X������Ӧ�����ӷ���ʽ_______________________________��
��2���ڲ�����п���pH=9.8����Ŀ����_______________________________��
��3��������A�ijɷ�Ϊ_____________���Լ�Y���ӱ�2��ѡ��Ӧ����________��
��4���ڲ�����з�����Ӧ�Ļ�ѧ����ʽ��_______________________________��
��5������ʵ��������ɲ���ޣ��������C������______�����������ƣ������ա�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ӱ���ˮ������ѧ�߶����¿�����ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵��������ǣ� ��
��NaHCO3��Һ��ˮϡ�ͣ�c(Na+)/ c(HCO3��)�ı�ֵ��������
��Ũ�Ⱦ�Ϊ0.1 mol��L��1��Na2CO3��NaHCO3�����Һ��2c(Na+)��3[c(CO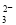 )+c(HCO
)+c(HCO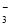
 )]
)]
����0.1 mol��L��1��ˮ�еμ�0.lmol��L��1���ᣬǡ����ȫ�к�ʱ��Һ��pH��a������ˮ���������c(OH��)��l0��amol��L��1
����0.1mol/LNa2SO3��Һ�м�������NaOH���壬c��Na+����c��SO32����������
����Na2Sϡ��Һ�У�c(H+)��c(OH��)+c(H2S)+c��HS����
A���� B���ڢ� C���٢� D���ڢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com