
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20-50mg/kg |
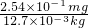 =
=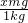 ,x=20,故答案为:20.
,x=20,故答案为:20.

科目:高中化学 来源: 题型:阅读理解
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
| 423 |
| w |
| 423 |
| w |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计算) | 20~50mg/kg |
| 分装日期 | \ |
| 分装企业 | \ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20-50mg/kg |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
查看答案和解析>>
科目:高中化学 来源:2013届福建省罗源县第一中学高三第一次月考化学试卷(带解析) 题型:填空题
(12分)北京市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com