
| A. | 白磷的分子式:P | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 氟离子的结构示意图: | D. | 过氧化氢的电子式: |
分析 A.白磷分子中含有4个P原子;
B.次氯酸的中心原子为O原子,分子中不存在氢氯键;
C.氟离子的核电荷数为7,最外层达到8电子稳定结构;
D.过氧化氢为共价化合物,分子中含有2个O-H键和1个O-O键.
解答 解:A.白磷分子中含有4个P原子,则白磷的分子式为:P4,故A错误;
B.次氯酸分子中含有1个H-Cl和1个O-H键,其正确的结构式为:H-O-Cl,故B错误;
C.氟离子核内质子数为9,核外电子数为10,其原子结构示意图为: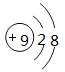 ,故C错误;
,故C错误;
D.双氧水属于共价化合物,含有2个O-H键和1个O-O键,其电子式为 ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、离子结构示意图、分子式、结构式等知识,明确常见化学用语的表示方法为解答关键,试题培养了学生的分析能力及规范答题能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
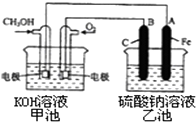 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它不稳定,在水中易发生岐
,它不稳定,在水中易发生岐| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
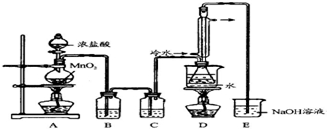
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(ClO-)=1.0 mol•L-1的溶液:Na+、SO32-、NO3-、SO42- | |
| B. | 0.1 mol•L-1Na2S溶液:SO42-、K+、Cl-、Cu2+ | |
| C. | 0.1 mol•L-1AgNO3 溶液:H+、K+、SO42-、Br- | |
| D. | 0.1 mol•L-1NaAlO2 溶液:OH-、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 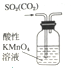 装置,除去SO2中混有的CO2 | |
| B. |  装置,用于亚硫酸钠和硫酸反应制取少量的SO2 | |
| C. | 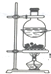 装置,分离NH4Cl和Ca(OH)2固体 | |
| D. | 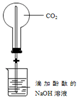 装置,做喷泉实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列关于“瘦肉精”的说法中正确的是( )
下列关于“瘦肉精”的说法中正确的是( )| A. | 摩尔质量为305.5 | |
| B. | 属于芳香族化合物,也是高分子化合物 | |
| C. | 1mol该有机物在一定条件下可与3 mol氢气发生加成反应 | |
| D. | 向此有机物中加入硝酸酸化的硝酸银溶液会产生淡黄色的沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com