
【题目】铝和氢氧化钾都是重要的工业产品。请回答:
(1)铝与氢氧化钾溶液反应的离子方程式是______________________________。
(2)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有____________(填序号)。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,________(填“能”或“不能”)说明固体混合物中无Fe2O3,理由是(用离子方程式说明)___________。
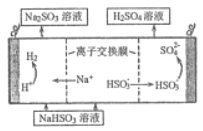
(3)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如下图所示。
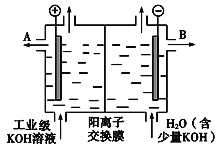
①该电解槽的阳极反应式是_______________________________。
②通电开始后,阴极附近溶液pH会增大,请简述原因____________________________。
③除去杂质后的氢氧化钾溶液从液体出口______(填写“A”或“B”)导出。
【答案】 2Al+2OH-+2H2O=2AlO![]() +3H2↑ bd 不能 Fe2O3+6H+=2Fe3++3H2O,Fe+2Fe3+=3Fe2+(或只写第二个反应) 4OH--4e-=2H2O+O2↑ H+放电,促进水的电离,OH-浓度增大 B
+3H2↑ bd 不能 Fe2O3+6H+=2Fe3++3H2O,Fe+2Fe3+=3Fe2+(或只写第二个反应) 4OH--4e-=2H2O+O2↑ H+放电,促进水的电离,OH-浓度增大 B
【解析】(1)铝与氢氧化钾溶液反应生成偏铝酸钾和氢气,正确答案:2Al+2OH-+2H2O=2AlO![]() +3H2↑;
+3H2↑;
(2)KClO3 为引发铝粉和Fe2O3反应的助燃剂,插入Mg条,然后点燃镁条,即可使铝热反应发生,正确选项:bd;
取少量铝热反应所得到的固体可能为铁、氧化铝、氧化铁等的混合物,将其溶于足量稀H2SO4,Fe+2H+= Fe2++H2 ↑ ,Fe2O3+6H+=2Fe3++3H2O,Fe+2Fe3+=3Fe2+,溶液中不存在Fe3+,所以滴加KSCN溶液无明显现象,但不能说明固体混合物中无Fe2O3;正确答案为:
不能; Fe2O3+6H+=2Fe3++3H2O,Fe+2Fe3+=3Fe2+(或只写第二个反应);
(3)①电解氢氧化钾的溶液,相当于电解水,阳极产生氧气,溶液中OH-失电子变为氧气;正确答案为:4OH--4e-=2H2O+O2↑;
②阴极极反应:2H++2e-=H2↑, 阴极附近溶液中c(H+)减少,c(OH-)增大,碱性增强,pH会增大;正确答案:H+放电,促进水的电离,OH-浓度增大;
③与电源负极相连的一极为电解池的阴极,除了产生氢气外,还会有氢氧化钾生成,所以氢氧化钾溶液从出口B流出;正确答案为 B;


科目:高中化学 来源: 题型:
【题目】(1)CCl4 和蒸馏水都是无色液体,请按下列要求用试验方法鉴别两者:
① 只允许用一种试剂:用两支试管分别取出少量的 CCl4和 蒸馏水 ,然后分别加入少量 的单质碘,振荡,呈紫红色的液体 是 _____,呈棕黄色的液体是 _____.
② 不用任何试剂:用试管取少量的其中一种液体,再加入另外一种液体,下层液体是______,上 层液体是_______。
(2)NaCl溶液中含有少量的CaCl2,某学生用过量的 Na2CO3使 Ca2+转化为沉淀而除 去,确认Na2CO3已 过量的实验 方法 是 : _____.
(3) 氢氧化铁胶体的制备方法是 _____。 发生反应的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学平衡状态的说法中正确的是( )
A. 改变外界条件不能改变化学平衡状态
B. 当某反应在一定条件下反应物转化率保持不变时即达到了化学平衡状态
C. 当某反应体系中气体的压强不再改变时,该反应一定达到平衡状态
D. 当某反应达到平衡状态时,反应物和生成物的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化学的认识中,正确的是()
A. CH3CH=CHCH3分子中的四个碳原子可能在同一直线上
B. 淀粉和纤维素属于多糖, 均可在在人体内水解转化为葡萄糖,为人类提供能量
C. 分子式为 C4H8O且能和金属钠反应的有机物共有三种(不考虑立体异构)
D. 分枝酸结构简式如图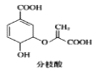 ,可与乙醇、乙酸反应,也可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
,可与乙醇、乙酸反应,也可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的实验装置进行电化学实验,下列判断正确的是( )
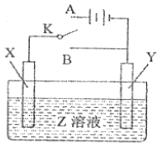
A. 若X为铝片,Y为镁片,Z为NaOH,将开关K置于B处则Y为原电池的负极
B. 若X为铜片,Y为铁片,Z为CuSO4,将开关K置于A处可实现在铁片上镀铜
C. 若X为铁片,Y为锌片,Z为NaCl,将开关K置于A或B处均可减缓铁的腐蚀
D. 若X、Y均为碳棒,Z为NaOH,将开关K置于A处,Y极发生的反应为2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1) 氧化还原法消除NOx的转化如下:
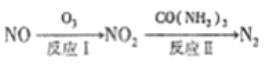
已知: NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ/mol
2NO(g)+O2(g)=2NO(g) △H=-116.2kJ/mol
则NO 与O3 只生成NO2 的热化学方程式为_____________________。
(2) 有人设想将CO按下列反应除去: 2CO(g)=2C(s)+O2(g) △H>0,请你分析该反应能否自发进行?_____( 填“是”或“否”),依据是_____________________。
(3)活性炭也可用于处理汽车尾气中的NO。在2L.恒容密闭容器中加入0.1000mo1NO和2.030mol 固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如下表:
固体活性炭/mol | NO/mol | A/mol | B/mol | |
200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 |
335℃ | 2.005 | 0.0500 | 0.0250 | 0.0250 |
①结合上表的数据,写出NO与活性炭反应的化学方程式______ 该反应的正反应为_______(填”吸热”或“放热”)反应。
②200℃时,平衡后向恒容容器中再充入0.1000mo1NO,再次平衡后,NO 的体积分数将____。(填“增大”、“减小”或“不变”)。
(4) 用亚硫酸钠溶液吸收二氧化硫得到亚硫酸氢钠溶液,然后电解该溶液可制得硫酸,电解原理示意图如图所示。请写出开始时阳极的电极反应式______________。
(5)常温下,Ksp(BaCO3) =2.5×10-9,Ksp(BaSO4) =1.0×10-10,控制条件可实现如下沉淀转换:
BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq) ,该反应平衡常数K的表达式为:K=_______,欲用1LNa2CO3 溶液将0.01molBaSO4 全部转化为BaCO3,则Na2CO3 溶液的最初浓度应不低于_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金与铁的物理性质的比较如下表所示:
熔点 | 密度 | 硬度 | 导电性 | |
某合金 | 2500 | 3.00 | 7.4 | 2.3 |
铁 | 1535 | 7.86 | 4.5 | 17 |
又知该合金耐腐蚀,强度大.从以上性能看,该合金不适合用作( )
A.导线
B.门窗框
C.炉具
D.飞机外壳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2RO3是一种二元酸,常温下,用1L 1 mol·L-1 Na2RO3溶液吸收RO2气体,溶液的pH随RO2气体的物质的量变化如图所示。下列说法中正确的是
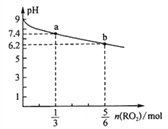
A. a点溶液中2c(Na+)<3c(RO32-)
B. 常温下,NaHRO3溶液中c(HRO3-)>c(RO32-)>c(H2RO3)
C. 向b点溶液中加水可使溶液的pH由6.2升高到8.0
D. 当吸收RO2的溶液呈中性时c(Na+)=2c(RO32-)+2c(HRO3-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com