
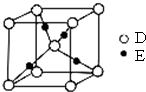
 已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满.回答下列问题(用元素符号或化学式表示).
已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满.回答下列问题(用元素符号或化学式表示).

 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
| R | ||
| X | T | Z |
| Q |
| A、非金属性:Z<T<X |
| B、R与Q的电子数相差26 |
| C、气态氢化物稳定性:R<T<Q |
| D、最高价氧化物的水化物的酸性:T<Q |
查看答案和解析>>
科目:高中化学 来源: 题型:
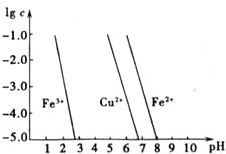 如图横坐标为溶液pH,纵坐标为金属离子物质的量浓度的对数值(当溶液中金属离子浓度≤10-5mol?L-1时,可认为沉淀完全),试回答:
如图横坐标为溶液pH,纵坐标为金属离子物质的量浓度的对数值(当溶液中金属离子浓度≤10-5mol?L-1时,可认为沉淀完全),试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K(HF)=7.2×10-4 |
| B、K(HNO2)=4.9×10-10 |
| C、必须根据其中三个反应才可得出结论 |
| D、K(HCN)<K(HNO2)<K(HF) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、工业上最重要的“人工固氮”反应:N2+3H2
| |||
B、工业法合成盐酸:H2+Cl2
| |||
C、工业上获取NaCl:2Na+Cl2
| |||
D、氯碱工业:2NaCl+2H2O
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com