
【题目】给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
![]()
![]()
![]()
![]()
【答案】D
【解析】
试题分析:A.SO2气体不能与BaCl2溶液反应生成白色沉淀,如果该反应能发生,则违反了焓判据(中强酸制强酸)和熵判据(无序的气体转化为有序排列的固体),A错误;B.SiO2属于不溶于水的酸性氧化物,不能与水直接反应生成硅酸,高锰酸(HMnO4)、重铬酸(H2Cr2O7)等含氧酸对应的酸性氧化物是Mn2O7、CrO3等金属氧化物,硫酸、硝酸、磷酸、碳酸等含氧酸对应的酸性氧化物是SO3、N2O5、P2O5、CO2等非金属氧化物,B错误;C.六水合氯化镁受热时发生分解、水解,最终所得固体为氧化镁,C错误;D.可溶性铜盐与过量烧碱溶液易反应生成新制氢氧化铜悬浊液,后者能氧化葡萄糖,加热时生成砖红色的沉淀(氧化亚铜),D正确;答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】 用括号中的试剂和方法除去各物质中的少量杂质,正确的是
A.苯中的甲苯(溴水、分液)
B.乙醇中的乙酸(NaOH溶液,分液)
C.乙醇中的水(新制CaO,蒸馏)
D.乙酸乙酯中的乙酸(NaOH溶液,分液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H=﹣746.5kJmol-1(条件为使用催化剂)
2CO2(g)+N2(g)△H=﹣746.5kJmol-1(条件为使用催化剂)
已知:2C(s)+O2(g)![]() 2CO(g)△H=﹣221.0kJmol-1
2CO(g)△H=﹣221.0kJmol-1
C(s)+O2(g)![]() CO2(g)△H=﹣393.5kJmol-1
CO2(g)△H=﹣393.5kJmol-1
则N2(g)+O2(g)=2NO(g) △H = kJmol-1。
(2)T ℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/10-4 mol/L | 10.0 | 4.50 | c1 | 1.50 | 1.00 | 1.00 |
c(CO)/10-3 mol/L | 3.60 | 3.05 | c2 | 2.75 | 2.70 | 2.70 |
则c2合理的数值为 (填字母标号)。
A.4.20 B.4.00 C.2.95 D.2.80
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2 L的恒容密闭容器中,进行反应:H2O(g)+CO(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO | H2 | |||
i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
iii | 900 | a | b | c | d | t |
若a=2,b=1,则c= ,达平衡时实验组ii中H2O(g)和实验组iii中CO的转化率的关系为αii(H2O) αiii(CO)(填“<”、“>”或“=”)。
(4)二甲醚是清洁能源,用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比![]() 的变化曲线如图1所示。
的变化曲线如图1所示。
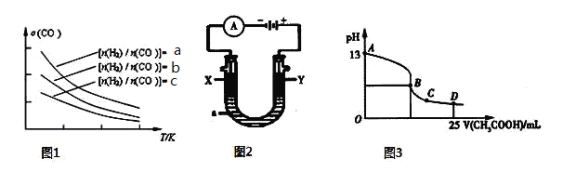
① a、b、c按从大到小的顺序排序为 。
② 根据图象可以判断该反应为 反应(填吸热或放热)。
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
① 负极的电极反应式为 。
② 以上述电池为电源,通过导线连接成图2。若X、Y为石墨,a为2 L 0.1 mol/L KCl溶液电解一段时间后,取25 mL 上述电解后的溶液,滴加0.4 mol/L醋酸得到图3曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。根据图2计算,上述电解过程中消耗一氧化碳的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天津港“8.12”特大火灾爆炸事故,造成了极其恶劣的社会影响。原因是化学危险 品随意堆放,管理人员安全意识淡漠,对人民的生命财产极不负责任。
下面是其中一部分危险品。请回答下列问题:
⑴ 写出过氧化氢的电子式
⑵ 上述危险品中,和水反应且符合下列条件的离子方程式
① 属于氧化还原反应 ② 水既不做氧化剂也不做还原剂
⑶ 4000C时,硝酸铵会发生爆炸,生成氮气、二氧化氮和水蒸气,20g硝酸铵爆炸放出QkJ的热量,试写出该反应的热化学方程式
⑷ 写出酸性高锰酸钾溶液与过氧化氢化应的离子方程式
⑸ 氰化钠有剧毒,为防止扩散,消防队员和工作人员离场前都用双氧水消毒。氰化钠和双氧水反应生成一种酸式盐和一种有刺激性气味的气体,反应的离子方程式是 ;调查查明现场有700吨的氰化钠,如果用密度为1.2g/mL质量分数为17%的双氧水进行消毒,最少需要这种双氧水_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2N2O5(g)=4NO2(g)+O2(g) △H=+56.8kJ/mol自发进行的原因
A. 是吸热反应; B. 是放热反应;
C. 是熵减少的反应; D. 熵增大效应大于能量效应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3: 物质结构与性质】
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
① Ti的基态原子价电子排布式为 。
② Fe的基态原子共有 种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3 CCl4==="2" KCl+2 CrO2Cl2+3 COCl2↑。
① 上述化学方程式中非金属元素电负性由大到小的顺序是 (用元素符号表示)。
② COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为 ,中心原子的杂化方式为 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO (填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为 。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是 cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c=397 pm;标准状况下氢气的密度为8.98×10-5 g·cm-3;储氢能力=![]() 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去),则W、X不可能是
选项 | W |
|
A | 稀硫酸 | NaAlO2溶液 |
B | 稀硝酸 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | Cl2 | Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列组成生物体的化学元素中属于微量元素的一组是
A. H、N、P、Mn、C
B. Cl、Fe、S、N、Mg
C. Cu、Zn、Mn、Mo、B
D. Fe、N、P、K、Cu、I
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com