
【题目】将铝粉与某铁的氧化物FeO2Fe2O3粉末配制成铝热剂,分成两等份.一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为15.68L;另一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为( )
A.11.20L
B.15.68L
C.22.40L
D.31.36L
【答案】A
【解析】解:一份直接放入足量的烧碱溶液中,铝与氢氧化钠发生反应生成氢气15.68L,氢气的物质的量为 ![]() =0.7mol.铁的氧化物FeO2Fe2O3中的氧原子全部与铝结合生成氧化铝,
=0.7mol.铁的氧化物FeO2Fe2O3中的氧原子全部与铝结合生成氧化铝,
所以根据关系式:
3H2~~~~ | 2Al~~~~ | 3O~~~~ | Al2O3 |
3 | 2 | 3 | |
0.7mol |
| 0.7mol |
由于氧化物为FeO2Fe2O3 , 根据氧原子守恒,所以氧化物FeO2Fe2O3的为 ![]() =0.1mol.
=0.1mol.
根据铁原子守恒,可知另一份生成的铁的物质的量为0.1mol×5=0.5mol.
根据Fe~H2可知,0.5molFe可生成氢气0.5mol,所以另一份生成的氢气的体积为0.5mol×22.4L/mol=11.2L.
故选:A.
【考点精析】认真审题,首先需要了解铝的化学性质(很快与O2反应,形成致密氧化膜,抗腐蚀性比镁强;在纯氧中或高温下可燃烧;与沸水只有微弱反应).


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】下列关于钠的说法中不正确的是
A. 自然界中的钠只以化合物的形式存在
B. 实验室剩余的钠需要放回原瓶
C. 钠的化学性质比较活泼,少量的钠可以保存在煤油中
D. 当钠与硫酸铜溶液反应时,有大量红色固体铜产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定容积、体积为2L的密闭容器中充入1mol N2和3mol H2发生反应,当反应进行到10s末时反应达到平衡,此时容器中c(NH3)=0.1molL﹣1 . 下列有关判断错误的是( )
A.反应达平衡时N2的转化率为10%
B.反应进行到10 s末时,H2的平均反应速率是0.03 mol(Ls)﹣1
C.该反应达到平衡时,N2的平衡浓度为0.45 mol/L
D.该反应达到平衡时的压强是起始时压强的0.95倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅又称硅石,是制备硅及其化合物的重要原料.下列说法正确的是
A. SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物
B. 在高温条件下SiO2能与过量的碳反应生成SiC,体现了二氧化硅的氧化性
C. 高温下SiO2能与Na2CO3反应放出CO2,不能说明H2SiO3的酸性强于H2CO3
D. 二氧化硅溶于水显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,试管中盛有水,气球a中盛有干燥的Na2O2颗粒,U形管中注有浅红色的水,将气球用橡皮筋紧缚在试管口.实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是
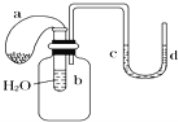
A. U形管内红色褪去
B. 试管内溶液变红
C. 气球a变瘪
D. U形管水位d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是
A.Na+、H+、Cl-、OH-B.Ag+、K+、Cl-、NO3–
C.Na+、H+、NO3– 、CO32-D.H+、Mg2+、SO42–、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色稀溶液X中,可能含有如表所列离子中的某几种.取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(y)的关系如图所示.下列说法正确的是( )
阴离子 | CO32﹣、SiO32﹣、[Al(OH)4]﹣、Cl﹣ |
阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
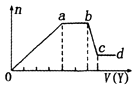
A.若Y是盐酸,则X中一定含有CO32﹣、SiO32﹣、[Al(OH)4]﹣和NH4+
B.若Y是NaOH溶液,则X中一定含有A13+、Fe3+、NH4+、Cl﹣
C.若Y是NaOH溶液,则ab段发生反应的离子方程式为:NH4++OH﹣═NH3↑+H2O
D.若Y是NaOH溶液,则X中的Al3+、Mg2+、NH4+物质的量之比为2:1:4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com