
【题目】有四种常见药物①阿司匹林②青霉素③胃舒平④麻黄碱。请回答:
(1)某同学胃酸过多,应选用的药物是___(填序号),抗酸药的成分Al(OH)3中和胃酸过多的离子方程式为___。
(2)由于具有兴奋作用,国际奥委会严禁运动员服用的药物是___(填序号,下同)。
(3)从用药安全角度考虑,使用前要进行皮肤敏感性测试的药物是___。
(4)阿司匹林药品标签上贴有OTC,它表示___, 滥用药物会导致不良后果,如过量服用___会出现水杨酸中毒,应立即停药,并静脉注射NaHCO3溶液。
科目:高中化学 来源: 题型:
【题目】乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置(夹持装置已略)如图所示:

下列说法错误的是
A.向圆底烧瓶中滴入H2O2溶液前需打开K
B.实验开始时需先加热②,再通O2,然后加热③
C.装置③中发生的反应为2CH3CH2OH +O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.实验结束时需先将④中的导管移出。再停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药药剂砒霜(主要成分As2O3,微溶于水)在医疗上用于治疗急性白血病。某课题组以一种含砷精矿石粉(主要成份为As4S4、As2S3、FeS2及其它惰性杂质)为原料制取As2O3,工艺流程图如下:
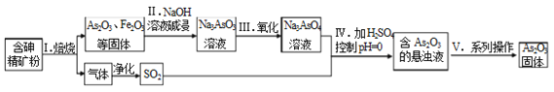
(1)过程 I 中所得SO2气体可回收再利用,下列有关SO2用途的说法正确的是_______。
A 工业制硫酸 B 漂白纸张 C 自来水消毒
(2)过程II中发生的反应_______氧化还原反应(填“是”或“不是”)。
(3)过程V中操作为_______(填实验基本操作名称)。
(4)①检验Na3AsO3溶液中是否含有Fe3+的实验操作_______。
②过程IV中生成As2O3的离子反应方程式为_______。
(5)有毒的AsO33-通过电解反应可转化为无毒的AsO43-。用石墨为电极,在强碱性溶液中电解含AsO33-的溶液,阳极的电极反应式为_______。
(6)测定某As2O3粗产品(含As2O5杂质)中As2O3的质量分数的实验过程如下:
a.称取m g粗产品溶解于NaOH溶液,得到含AsO33-、AsO43-的混合溶液100mL。
b.分别移取25.00mL上述溶液,用0.02500mol·L1的I2标准溶液进行滴定(I2将AsO33-氧化为AsO43-,淀粉溶液为指示剂)。每次滴定开始时液面读数如图一所示,三次滴定结束时,I2 标准溶液液面读数如图二~图四所示。
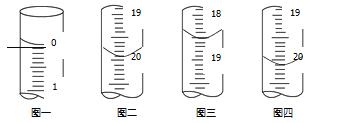
①描述滴定终点的现象_______。
②粗产品中As2O3的质量分数为_______(用含有m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L某混合溶液,只可能含有下表中的若干种离子:
可能大量含有的阳离子 |
|
可能大量含有的阴离子 |
|
当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是![]()
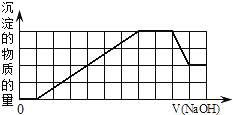
A.原溶液中加入盐酸有沉淀生成
B.原溶液中一定含有![]() 和
和![]()
C.反应最后得到的沉淀只有![]()
D.反应最后形成的溶液中溶质只有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO,反应物和产物的相关数据列表如下:
CH3CH2CH2CHO,反应物和产物的相关数据列表如下:
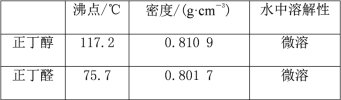
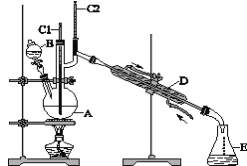
实验步骤如下:
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,与5mL浓硫酸形成混合溶液,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g。
(1)实验中,Na2Cr2O7溶液和浓硫酸添加的顺序为__________。
(2)加入沸石的作用是_______________。 若加热后发现未加沸石,应采取的正确方法是_________。
(3)上述装置图中,D仪器的名称是______________,E仪器的名称是_______。
(4)分液漏斗使用前必须进行的操作是_________。
(5)将正丁醛粗产品置于分液漏斗中分水时,正丁醛在_______层(填“上”或“下”)。
(6)本实验中,正丁醛的产率为_______%(结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,将0.10 mol·L-1 CH3COOH溶液滴加到10 mL 0.10 mol·L-1 NaOH溶液中,lg![]() 与pH的关系如图所示,C点坐标是(6,1.7)。下列说法不正确的是( )
与pH的关系如图所示,C点坐标是(6,1.7)。下列说法不正确的是( )
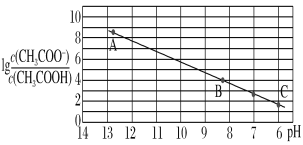
A. pH=7时加入的醋酸溶液的体积大于10 mL
B. C点后继续加入醋酸溶液,水的电离程度减小
C. B点存在c(Na+)-c(CH3COO-)=(10-6-10-8)mol·L-1
D. Ka(CH3COOH)=5.0×10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是

A. HS-在硫氧化菌作用下转化为SO42-的反应为:HS-+4H2O-8e-== SO42-+9H+
B. 电子从b流出,经外电路流向a
C. 如果将反应物直接燃烧,能量的利用率不会变化
D. 若该电池电路中有0.4mol电子发生转移,则有0.45molH+通过质子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于放热反应H2 + Cl2![]() 2HCl,下列说法正确的是:
2HCl,下列说法正确的是:
A.产物所具有的总能量高于反应物所具有的总能量
B.反应物所具有的总能量高于产物所具有的总能量
C.断开1mol H—H键和1mol Cl—Cl键所吸收的总能量小于形成1mol H—Cl键所放出的能量
D.该反应中,化学能只有转变为热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.芳香烃是分子组成符合CnH2n-6(n≥6)的一类物质
B.苯和浓硝酸在55~60℃,浓硫酸存在时发生硝化反应
C.甲苯可以和浓硝酸与浓硫酸的混合物发生硝化反应
D.等质量的烃(CxHy)耗氧量取决于![]() 的值,越大则耗氧多
的值,越大则耗氧多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com