
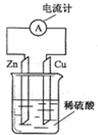
 如图所示的原电池装置
如图所示的原电池装置

 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
| A、相同浓度的两溶液中c(H+)相同 |
| B、100mL 0.1mol/L的两溶液能中和等物质的量的氢氧化钠 |
| C、pH=3的两溶液都稀释10倍,盐酸的pH大于醋酸的PH |
| D、两溶液中分别加人少量对应的钠盐,c(H+)均明显减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白质溶液中加入CuSO4溶液产生盐析现象 |
| B、蛋白质溶液不能产生丁达尔效应 |
| C、羊毛、棉花的主要成分都是蛋白质 |
| D、蛋白质在紫外线的照射下将会失去生理活性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、降低温度,正反应速率降低,逆反应速率升高 |
| B、使用催化剂将缩短达到平衡的时间 |
| C、达到平衡后,保持温度和容积不变,充入氩气,正、逆反应速率同等倍数增大 |
| D、达到平衡后,保持温度和压强不变,充入氩气,正、逆反应速率增加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com