
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| D. | FeCl2溶液跟Cl2反应:2Fe2++Cl2═2Fe3++2Cl- |
分析 A.转移电子不守恒、方程式左右原子不守恒;
B.氯化铝加入过量氨水生成氢氧化铝沉淀和氯化铵,氢氧化铝难溶于弱碱氨水;
C.方程式左右氢原子不守恒;
D.二价铁离子具有还原性,能被氯气氧化成三价铁离子,离子方程式书写正确.
解答 解:A.铝粉投入到NaOH溶液中生成偏铝酸钠和氢气,离子方程式为:2H2O+2Al+2OH-═2AlO2-+3H2↑,故A错误;
B.氯化铝加入足量氨水生成氢氧化铝沉淀和氯化铵,氢氧化铝难溶于弱碱氨水,反应的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B错误;
C.钠与水反应化学方程式为:2Na+2H2O=2NaOH+H2↑,氢氧化钠拆开,反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故C错误;
D.氯化亚铁溶液与氯气反应的化学方程式为:2FeCl2+Cl2=2FeCl3,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故D正确;
故选D.
点评 本题考查离子方程式正误判断,明确离子方程式书写规则及物质性质即可解答,检验方法有:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡含有食品添加剂的食物对人体健康均有害,不宜食用 | |
| B. | 可用米汤检验含碘盐中的碘酸钾(KIO3) | |
| C. | 涤纶、绵纶、棉花、羊毛、蚕丝等都是天然纤维素 | |
| D. | 纤维素属于糖类,不能够直接被消化成为人体的营养物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂,但不能导电.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.关于这两种晶体的说法,正确的是( )
氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂,但不能导电.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.关于这两种晶体的说法,正确的是( )| A. | 立方相氮化硼含配位键B→N | |
| B. | 六方相氮化硼层间作用力小,所以质地软,熔点低 | |
| C. | 两种氮化硼中的硼原子都是采用sp2杂化 | |
| D. | 六方相氮化硼晶体其结构与石墨相似却不导电,原因是没有可以自由移动的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ②③⑥ | C. | ①④⑤ | D. | ②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酚酞试纸 | B. | 用湿润的蓝色石蕊试纸 | ||
| C. | 用硝酸银溶液 | D. | 用湿润的淀粉-KI试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 实验步骤(内容) | 现象 |
| ① | 在贴有标签a、b的试管中分别加入1.0g Na2CO3固体和NaHCO3固体,观察外观. | / |
| ② | 分别滴入几滴水,振荡,摸试管底部. | 试管a放热现象更明显(填“a”或“b”) |
| ③ | 继续向两试管中分别加入10.0mL水,用力振荡,观察现象. | / |
| ④ | 再分别向两试管中滴加2滴酚酞溶液,观察现象. | 溶液均变红,颜色较深的试管是a(填“a”或“b”). |
| ⑤ | 最后分别向两溶液中滴加足量盐酸. | 红色褪去,均有无色气体产生.经计算生成气体的是a<b(填“>”“<”或“=”) |
| ⑥ | 加热大试管一段时间.(注:棉花球沾有无水硫酸铜粉末)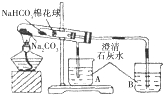 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
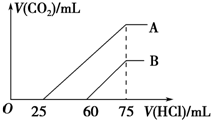 向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.在稀释后的溶液中逐滴加入0.1mol.L-1的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示.下列说法正确的是( )
向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.在稀释后的溶液中逐滴加入0.1mol.L-1的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示.下列说法正确的是( )| A. | 在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是①NaOH、Na2CO3 ②Na2CO3③Na2CO3、NaHCO3 ④NaHCO3 | |
| B. | B曲线说明,原溶液通入CO2后,所得溶质与盐酸反应产生CO2的最大体积是11.2L(标准状况) | |
| C. | 原NaOH溶液的物质的量浓度为0.100mol/L | |
| D. | B曲线表明,原溶液通入CO2后,所得溶液中溶质的化学式为NaOH、Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gH2O中含有的质子数为10NA | |
| B. | 常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2NA | |
| C. | 46g NO2和N2O4混合气体中含有原子总数为3NA | |
| D. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com