
| 温度范围(℃) | 固体质量(g) |
| 150-210 | 4.41 |
| 290-320 | 2.41 |
| 890-920 | 2.25 |
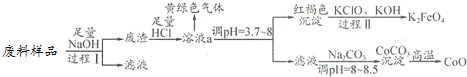
分析 工业废料中主要含有Al2O3、Co2O3•CoO、少量Fe3O4等,加入氢氧化钠发生反应的是两性氧化物氧化铝,经过滤,滤渣中含Co2O3•CoO、少量Fe3O4,加入盐酸,三价钴氧化亚铁离子和氯离子,生成二氯化钴、氯化铁和氯气,然后调节溶液的PH使铁离子沉淀,过滤得到氢氧化铁和滤液,由此分析解答;
(1)过程Ⅰ中的操作名称是过滤;氧化铝与氢氧化钠反应生成偏铝酸钠和水,化学方程式为:Al2O3+2NaOH═2NaAlO2+H2O;
(2)溶液a中含有金属离子有Co2+、Fe3+;
(3)①氯气与水反应生成的次氯酸有漂白性;
②液氯和氯水均为液体,且都含有氯分子;
③将氯气通入碱液时,生成+1价的次氯酸钠和-1价的氯化钠,氯的化合价有升也有降,所以氯气既是氧化剂,又是还原剂;
④次氯酸见光易分解,说明次氯酸不稳定性;
⑤向氯水中滴硝酸银溶液,有白色沉淀氯化银生成,说明氯水中含Cl-;
(4)过程Ⅱ是将氢氧化铁氧化成高铁酸钾,发生反应的离子方程式为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+5H2O+3Cl-;电解池的阳极发生氧化反应,电极反应式为:Fe(OH)3-3e-+5OH-═FeO42-+4H2O;
(5)计算晶体物质的量n=$\frac{5.49g}{183g/mol}$=0.03mol,失去结晶水应为0.06mol,固体质量变化=0.06mol×18g/mol=1.08g,图表数据可知,150℃~210℃固体质量变化=5.49g=4.41g=1.08g,说明210℃失去结晶水得到CoC2O4;
210℃~290℃过程中是CoC2O4发生的反应,210℃~290℃过程中产生的气体只有CO2 ,依据元素守恒得到生成CO2物质的量为0.06mol,质量=0.06mol×44g/mol=2.64g,气体质量共计减小=4.41g-2.41g=2g,说明不是分解反应,参加反应的还有氧气,则反应的氧气质量=2.64g-2g=0.64g,O2物质的量=$\frac{0.64g}{32g/mol}$=0.02mol,依据原子守恒配平书写反应的化学方程式.
解答 解:(1)过程Ⅰ中的操作名称是过滤;氧化铝与氢氧化钠反应生成偏铝酸钠和水,化学方程式为:Al2O3+2NaOH═2NaAlO2+H2O,故答案为:过滤;Al2O3+2NaOH═2NaAlO2+H2O;
(2)溶液a中含有金属离子有Co2+、Fe3+,故答案为:Co2+、Fe3+;
(3)①氯气与水反应生成的次氯酸有漂白性,而不是氯气的漂白性,故错误;
②液氯和氯水均为液体,且都含有氯分子,故正确;
③将氯气通入碱液时,生成+1价的次氯酸钠和-1价的氯化钠,氯的化合价有升也有降,所以氯气既是氧化剂,又是还原剂,故正确;
④次氯酸见光易分解,说明次氯酸不稳定性,故错误;
⑤向氯水中滴硝酸银溶液,有白色沉淀氯化银生成,说明氯水中含Cl-,故正确;
故选:①、④;
(4)过程Ⅱ是将氢氧化铁氧化成高铁酸钾,发生反应的离子方程式为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+5H2O+3Cl-;电解池的阳极发生氧化反应,电极反应式为:Fe(OH)3-3e-+5OH-═FeO42-+4H2O,故答案为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+5H2O+3Cl-;Fe(OH)3-3e-+5OH-═FeO42-+4H2O;
(5)计算晶体物质的量n=$\frac{5.49g}{183g/mol}$=0.03mol,失去结晶水应为0.06mol,固体质量变化=0.06mol×18g/mol=1.08g,图表数据可知,150℃~210℃固体质量变化=5.49g=4.41g=1.08g,说明210°C失去结晶水得到CoC2O4,210℃~290℃过程中是CoC2O4发生的反应,产生的气体只有CO2 ,依据元素守恒得到生成CO2物质的量为0.06mol,质量=0.06mol×44g/mol=2.64g,气体质量共计减小=4.41g-2.41g=2g,说明说明有气体参加反应应为氧气,则反应的氧气质量=2.64g-2g=0.64g,O2物质的量=$\frac{0.64g}{32g/mol}$=0.02mol;n(CoC2O4):n(O2):n(CO2)=0.03:0.02:0.06=3:2:6,依据原子守恒配平书写反应的化学方程式为3CoC2O4+2O2$\frac{\underline{\;210℃~290℃\;}}{\;}$Co3O4+6CO2,
故答案为:3CoC2O4+2O2$\frac{\underline{\;210℃~290℃\;}}{\;}$Co3O4+6CO2.
点评 本题通过从某工业废料中回收钴的工艺流程考查了化学方程式、离子方程式书写,确各个阶段固体成分及先后分解生成物成分是解本题关键,题目难度中等.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,48g O3含有的分子数为NA | |
| B. | 1molNa2O2晶体中阴离子数为2 NA | |
| C. | 标准状况下,33.6L的 四氯化碳(CCl4)中含有的碳原子数目为1.5NA | |
| D. | 常温常压下,7.1 g Cl2与足量的Fe充分反应,转移的电子数目为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
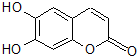 中草药秦皮中含有的七叶树内酯(如图)具有抗菌作用.若1mol该物质分别与浓溴水和H2完全反应,则消耗的Br2和H2的物质的量最多分别为( )
中草药秦皮中含有的七叶树内酯(如图)具有抗菌作用.若1mol该物质分别与浓溴水和H2完全反应,则消耗的Br2和H2的物质的量最多分别为( )| A. | 2molBr2 3molH2 | B. | 2molBr2 4molH2 | C. | 3molBr2 4molH2 | D. | 3molBr2 5molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径由小到大排序为:X<Y<Z<W | |
| B. | Z的最高价氧化物既能与某酸反应,又能与某碱反应,属于两性物质 | |
| C. | Y单质在一定条件下可以跟四氧化三铁发生置换反应 | |
| D. | 室温下,0.1 mol•L-1 W的气态氢化物的水溶液中氢离子的浓度为0.2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的无色溶液:Na+、Cu2+、NO3-、SO42- | |
| B. | 能溶解Al(OH)3固体的溶液:K+、Na+、HCO3-、SO42- | |
| C. | 水电离出的c(H+)=10-12mol/L的溶液:Ba2+、Na+、Cl-、NO3- | |
| D. | 能使淀粉KI试纸变蓝的溶液:K+、Fe2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com